
【题目】下列有关实验原理、装置、操作或结论的描述,错误的是( )

A. 图1所示装置可实现甲烷与氯气在光照条件下的取代反应
B. 图2所示装置可分离CH3CH2OH和CH3COOC2H5的混合液
C. 图3所示装置可用锌粒与稀硫酸反应制备氢气
D. 图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
【答案】D
【解析】
A.光照下甲烷与氯气发生取代反应;B.CH3CH2OH和CH3COOC2H5的混合液互溶、不分层;C.锌粒与稀硫酸发生氧化还原反应生成氢气;D.浓硫酸具有脱水性,使蔗糖碳化后,C与浓硫酸反应生成二氧化硫,品红、高锰酸钾均褪色。
光照下甲烷与氯气发生取代反应,则图中装置可实现甲烷与氯气在光照条件下的取代反应生成氯代烃和HCl,A正确,不合题意;CH3CH2OH和CH3COOC2H5的混合液互溶、不分层,不能利用图中分液漏斗分离,B错误;锌粒与稀硫酸发生氧化还原反应生成氢气, 此装置可以为气体的发生装置,C正确,不合题意;浓硫酸具有脱水性,使蔗糖碳化后,C与浓硫酸发生氧化还原反应生成二氧化硫,体现浓硫酸的强氧化性,图中品红、高锰酸钾均褪色,品红褪色与二氧化硫的漂白性有关,高锰酸钾褪色与二氧化硫的还原性有关,D正确,不合题意;答案选B。


科目:高中化学 来源: 题型:
【题目】用质量分数为98%,密度为1.84 g·cm-3的浓硫酸配制200 mL 1.84 mol·L-1的稀硫酸,提供的仪器有:A.100 mL量筒,B.20 mL量筒,C.200 mL容量瓶,D.500 mL容量瓶,E.50 mL烧杯,F.胶头滴管,G.玻璃棒。
(1)配制该溶液,应取用浓硫酸的体积为________。
(2)实验操作过程中,应选用仪器的先后顺序是________________(填字母)。
(3)配制过程中若出现以下情况,对所配稀硫酸的浓度有什么影响?(填“偏大”“偏小”或“无影响”)
①用量筒量取浓硫酸时,俯视量筒刻度线:________。
②用于引流的玻璃棒没有洗涤:________________。
③定容时,仰视观察容量瓶刻度线:________________。
④定容后摇匀,发现液面低于刻度线,又滴加水至液面与刻度线刚好相平:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下Kb(NH3·H2O)=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是( )

A. 0.1mol·L-1HR溶液的pH约为5 B. HR为弱酸,常温时Ka(HR)=1.0×10-7
C. 当通入0.1molNH3时,溶液中c(R-)<c(NH4+) D. 当c(HR)=c(R-)时,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )

A. 锌电极上发生的反应:Zn2++2e-===Zn
B. 电池工作一段时间后,甲池的c(SO![]() )减小
)减小
C. 电流由锌电极经电流表流向铜电极
D. 电池工作一段时间后,乙池溶液的总质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在15mL0.lmol·L-1KOH溶液中逐滴加入0.2mol·L-1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( )
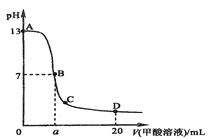
A. 在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5
B. 在A、B间任意一点,c(HCOO-)>c(K+)>c(OH-)>c(H+)
C. 在D点:c(HCOO-)+c(HCOOH)>2c(K+)
D. B→C段:水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中含酚废水中有机物可用C6H5OH表示,左、中、右室间分别以离子交换膜分隔。下列说法不正确的是

A. 右室电极为该电池的正极
B. 左室电极反应式可表示为:C6H5OH-28e-+11H2O=6CO2↑+28H+
C. 右室电极附近溶液的pH减小
D. 工作时左侧离子交换膜为阴离子交换膜,右侧离子交换膜为阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾常用作消毒剂、水质净化剂等。工业上用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)制备高锰酸钾晶体的一种工艺流程如下:
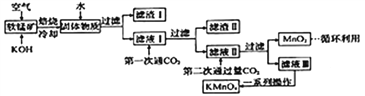
回答下列问题:
(1)焙烧过程中发生的主要反应为MnO2+KOH+O2![]() K2MnO4+H2O,该反应配平后MnO2与O2的系数比为________。采用对空气加压的方法可提高MnO2的利用率。原因是__________________________。
K2MnO4+H2O,该反应配平后MnO2与O2的系数比为________。采用对空气加压的方法可提高MnO2的利用率。原因是__________________________。
(2)滤渣Ⅱ是________,第一次通CO2不能用稀盐酸代替的原因是____________________________。
(3)第二次通入过量CO2生成MnO2的离子方程式为__________________________。
(4)由下图可知,从滤液Ⅲ得到高锰酸钾晶体需经过________、________、洗涤等一系列操作。
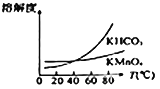
(5)1t含MnO287%的软锰矿,理论上最多可制得________tKMnO4晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用乙烯和乙醇为原料制取草酸二乙酯的过程中发生的反应类型及顺序正确的是
①酯化反应 ②氧化反应 ③水解反应 ④加成反应
A. ②④③① B. ④①②③ C. ④③②① D. ②③①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com