
【题目】根据热化学方程式2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,下列说法或表达正确的是( )
A. 2 mol水蒸气分解生成2 mol氢气与1 mol氧气需吸收483.6 kJ的热量
B. 2H2(g)+O2(g)===2H2O(l) ΔH>-483.6 kJ·mol-1
C. H2(g)+![]() O2(g)===H2O(g) ΔH=241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=241.8 kJ·mol-1
D. 1 mol氢气与0.5 mol 氧气总能量小于1 mol水蒸气的总能量
【答案】A
【解析】
已知2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ·mol-1,反应放热,反应物总能量大于生成物总能量,物质的聚集不同,能量不同,吸收或放出的热量不同,结合热化学方程式进行判断.
A、互为逆反应的两个反应,热量的吸收或放出正好相反,但吸收或放出的热量相等,表现在热化学方程式中就是热量的绝对值相等,符号相反,故A正确;B、气态水变成液态水要放出热量,故等量的氢气与氧气反应生成液态水放出的热量要多于生成气态水放出的热量,故B错误C、氢气与氧气反应为放热反应,ΔH为负值,故C错误;D、1 mol 氢气与 0.5 mol 氧气总能量大于1 mol 水蒸气的总能量,故D错误。故选A。


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
【题目】(题文)某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
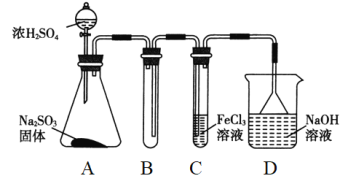
(1)通入足量SO2时C中观察到的现象是______________________。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:_______________________;
②请设计实验方案检验有Fe2+生成:_________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法_____(填“合理”或“不合理”),理由是______。
(3)D装置中倒置漏斗的作用是__________________________。
(4)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填字母)。
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据学过的化学知识填空:
(1)金刚石和石墨物理性质差异较大的原因是____________________;一氧化碳和二氧化碳性质不同的原因是_____________________。
(2)天然气的主要成分燃烧的化学方程式是_________________________。
(3)煤在空气中燃烧需要满足的条件是__________;吹灭蜡烛的原理是____________。
(4)生铁和钢都是铁的合金,由于________不同,二者性能不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了回收一块质量为40g的铜锌合金中的铜,将该合金放入烧杯中,逐渐加入稀硫酸至不再产生气泡,烧杯内剩余固体27g,求反应中产生气体的质量。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在15mL0.lmol·L-1KOH溶液中逐滴加入0.2mol·L-1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( )
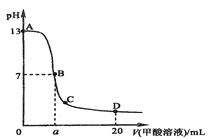
A. 在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5
B. 在A、B间任意一点,c(HCOO-)>c(K+)>c(OH-)>c(H+)
C. 在D点:c(HCOO-)+c(HCOOH)>2c(K+)
D. B→C段:水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,相同浓度的三种一元弱酸(HX、HY、HZ)、强酸、纯水分别用相同浓度的NaOH 溶液滴定,所得溶液的pH 与滴入NaOH 溶液的体积关系如图所示。已知滴定过程中存在:当c(HX)=c(X-) 时,pH=10;c(HY)=c(Y- )时,pH=7;c(HZ)=c(Z-)时,pH=4。下列说法正确的是( )
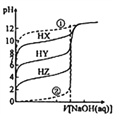
A. ①为强酸的滴定曲线 B. 酸性强弱:HX>HY>HZ
C. 滴定HX溶液可用甲基橙作指示剂 D. HZ+Y-![]() HY+Z-的平衡常数为K=1.0×103
HY+Z-的平衡常数为K=1.0×103
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)基态氟原子的价电子排布式为_________________。
(2)C2F4可用于合成聚四氟乙烯,HBF4可用于蚀刻玻璃,NO2F可用作火箭推进剂中的氧化剂,NaAlF6可用作电冶铝的助培剂。
①C2F4分子中所含共价键的类型有_____,C2F4分子中碳原子的杂化轨道类型是____,聚四氟乙烯是一种准晶体,证明它不是晶体可用的实验方法是_______________。
②HF与BF3化合可得到HBF4,从价键形成角度分析HF与BF3能化合的原因_______________。
③与NO2F分子互为等电子的非极性分子有__________(写一个符合要求的化学式即可)。
(3)CaF2的晶体结构如图所示。
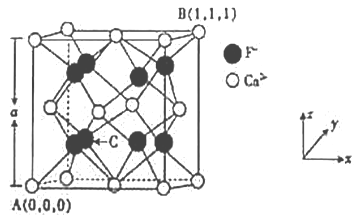
①CaF2晶胞中,Ca2+的配位数为_____;F-的配位数为_____。
②原子坐标参数可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的原子坐标参数为______________。
③晶胞参数可描述晶胞的大小和形状,CaF2晶胞的晶胞参数。A=546.2pm,则其密度为_____(列出计算式即可)g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com