
����Ŀ���⻯���(IiAlH4)���л��ϳ��е���Ҫ��ԭ����ij���������ʵ���Ʊ��⻯��﮲��ⶨ�䴿�ȡ���֪: �⻯��ﮡ��⻯���ˮ�����ҷ�Ӧ��������ͬһ�����塣
�ش���������:
I.�Ʊ��⻯�(IiH)
ѡ��ͼ1�е�װ���Ʊ��⻯�(��Ҫʱ���ظ�ʹ��):
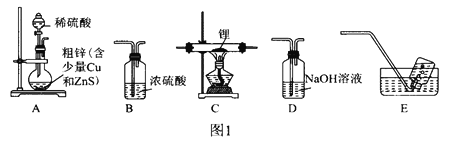
(1)װ��D��NaOH��Һ��������________________________________________��
(2)װ�õ�����˳��(������ʯ)ΪA��__________________________________��
(3)�����װ�õ�����������ȼ�ƾ���ǰ����е�ʵ�������____________________________________��
II.�Ʊ��⻯����
1947 ����Schlesinger��Bond ��Finholt�״��Ƶ��⻯�������䷽����ʹ�⻯�����ˮ���Ȼ������������������л�ϣ����裬��ַ�Ӧ������һϵ�в����õ�LiAlH4���塣
(4)�����ѻ�Ϊȥ����ˮ�Ƿ���������������:____________________________________��
(5)�⻯�����ˮ���Ȼ�����Ӧ�Ļ�ѧ����ʽΪ___________________________________��
III.�ⶨ�⻯��﮲�Ʒ(�����⻯�)�Ĵ�����
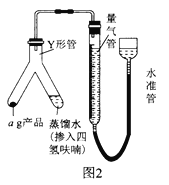
(6)��ͼ2װ�����������װ�������Բ�װ��ԼƷ(Y�ι��е�����ˮ������Ϊ�˱����⻯�����ˮ������ը������ˮ��������������ϡ�ͼ�)��������Ӧ�IJ�����_________________������֮ǰ�������ƹ����������Ҳ��������ʹ���������������Һ����ͬһˮƽ��������Ŀ����___________________________��
(7)��״���£���Ӧǰ�����ܶ���ΪV1mL����Ӧ��ϲ���ȴ֮�������ܶ���ΪV2mL������Ʒ�Ĵ���Ϊ_____________________(�ú�a��V1��V2�Ĵ���ʽ��ʾ)������ʼ����ʱ���ӿ̶��ߣ���õĽ����___________(����ƫ������ƫ����������Ӱ����)��
���𰸡� ��ȥH2�л��е�H2S DBCBE ��װ��A�з�Һ©���Ļ����Ͳ�������һ��ʱ�����С�Թ���װ��E��ˮ�����ռ����岢�鴿 �����У���Ϊ�⻯��ﮡ��⻯���ˮ�����ҷ�Ӧ 4LiH+AlCl3==LiAlH4+3LiC1 ��бY�ιܣ�������ˮע��ag��Ʒ�� ʹ�������������ѹǿ�����ѹǿ��� {[19(V2�CV1)]/448a}% ƫ��
��������ѡ��ͼ1�е�װ���Ʊ��⻯ﮣ�Ӧ������װ��A��ȡ���������Ƶ������к������⼰ˮ������ͨ��װ��D������������Һ�����ⷴӦ��ȥ�����е����⣬��ͨ��װ��BŨ�������õ������������������������ڼ��������·�Ӧ�����⻯ﮣ�������װ��B��ֹ�����е�ˮ��������װ��C�����δ��Ӧ�������ռ�������������������ը��(1)װ��D��NaOH��Һ�������dz�ȥH2�л��е�H2S��(2)װ�õ�����˳��(������ʯ)ΪA��DBCBE��(3)�����װ�õ�����������ȼ�ƾ���ǰ����е�ʵ������Ǵ�װ��A�з�Һ©���Ļ����Ͳ�������һ��ʱ�����С�Թ���װ��E��ˮ�����ռ����岢�鴿��(4)�����ѻ�Ϊȥ����ˮ����������Ϊ�⻯��ﮡ��⻯���ˮ�����ҷ�Ӧ��(5)�⻯�����ˮ���Ȼ�����Ӧ����LiAlH4��LiC1����Ӧ�Ļ�ѧ����ʽΪ4LiH+AlCl3==LiAlH4+3LiC1��(6) Y�ι��е�����ˮ������Ϊ�˱����⻯�����ˮ������ը������ˮ��������������ϡ�ͼ���������Ӧ�IJ�������бY�ιܣ�������ˮע��ag��Ʒ�У�����֮ǰ�������ƹ����������Ҳ��������ʹ���������������Һ����ͬһˮƽ��������Ŀ����ʹ�������������ѹǿ�����ѹǿ��ȣ�(7)���ݷ�ӦLiAlH4+2H2O==4H2��+LiAlO2��֪����Ʒ�Ĵ���Ϊ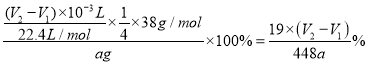 ������ʼ����ʱ���ӿ̶��ߣ�����������ƫ�ⶨ�����ƫ����
������ʼ����ʱ���ӿ̶��ߣ�����������ƫ�ⶨ�����ƫ����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��5���л���ѧ����
�л����㷺Ӧ���ں��ա��������ǣ����һ�ֺϳ�·�����£�
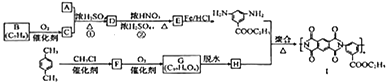
��֪�����л���A������ͼ��˴Ź�������ͼ���£�
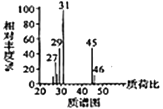
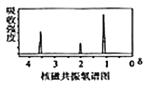
��2RCOOH![]()
![]() +H2O
+H2O
��
�ش��������⣺
(1)A�Ļ�ѧ������________��C�к��������ŵ�������________��
(2)�ڵķ�Ӧ����Ϊ_________����ķ���ʽΪ_________��
(3)�ٵķ�Ӧ����ʽΪ_______________________________________��
(4)F�Ľṹ��ʽ��______________��
(5)ͬʱ��������������G��ͬ���칹�干��________��(��������ṹ)��д�����е�һ�ֽṹʽ��__________��
���ܷ���������Ӧ
���ܷ���ˮ�ⷴӦ����ˮ�����֮һ����FeCl3��Һ������ɫ��Ӧ
��1mol�������������8molNaOH��Ӧ
(6)д���ü���ױ��ͼ״�Ϊԭ���Ʊ�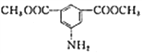 �ĺϳ�·�ߣ�________________(�����Լ���ѡ)��
�ĺϳ�·�ߣ�________________(�����Լ���ѡ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I2��KI��Һ�д�������ƽ�⣺I2��aq��+I����aq��![]() I3����aq����ijI2��KI�����Һ�У�c��I3�������¶�T�Ĺ�ϵ��ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������˵����ȷ���ǣ� ��
I3����aq����ijI2��KI�����Һ�У�c��I3�������¶�T�Ĺ�ϵ��ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬��������˵����ȷ���ǣ� ��
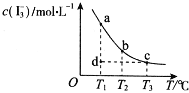
A. ��Ӧ I2��aq��+I����aq��![]() I3����aq����H��0
I3����aq����H��0
B. ���¶�ΪT1��T2����Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2����K2��K1
C. ��T1ʱ����Ӧ���е�״̬dʱ��һ��������������
D. ״̬a��״̬b��ȣ�״̬bʱI2��ת���ʸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Co�����仯�����ڹ�ҵ���й㷺Ӧ�á�Ϊ��ij��ҵ�����л�����,ijѧ��������������������к���Al��Li��Co2O3��Fe2O3����������
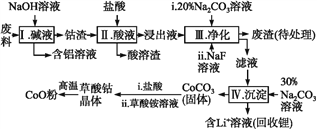
��֪:�������ܽ���:LiF������ˮ,Li2CO3����ˮ;
�ڲ��ֽ��������γ��������������pH���±���
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(��ʼ����) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(��ȫ����) | 3.2 | 9.15 | 1.09 | 4.7 |
��ش�:
��1���������еõ�������Һ�ķ�Ӧ�����ӷ���ʽ��__________��
��2��д����������Co2O3�����ᷴӦ����Cl2�����ӷ���ʽ:______��
��3����������Na2CO3��Һ�������ǵ�����Һ��pH,Ӧʹ��Һ��pH������______;�����е���Ҫ�ɷֳ���LiF��,����______��
��4��NaF����Һ�е�Li+�γ�LiF����,�˷�Ӧ�Բ����������������______��
��5���ڿ����м���5.49 g�����ܾ�����CoC2O4��2H2O����Ʒ,���ȹ����в�ͬ�¶ȷ�Χ�ڷֱ�õ�һ�ֹ�������,�����������
�¶ȷ�Χ/�� | ��������/g |
150~210 | 4.41 |
290~320 | 2.41 |
890~920 | 2.25 |
�ټ��ȵ�210 ��ʱ,�������������ԭ����__________��
�ھ��ⶨ,���ȵ�210~290 �������е�������ֻ��CO2���ܵ�������span>,�˹��̷�����Ӧ�Ļ�ѧ����ʽΪ___________��[��֪M(CoC2O4��2H2O)=183 g��mol-1]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� NAΪ�����ӵ���������ֵ������˵����ȷ����
A. ��״���£� 78g ���к���̼̼˫������Ŀ�� 3 NA
B. 18g D2O ���� 10NA������
C. 28 g ����ϩ�к��е�ԭ����ĿΪ 6NA
D. 56g ��ƬͶ������Ũ H2SO4������ NA�� SO2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɺ�ͭ������ͭ��һ�ַ����ǣ�
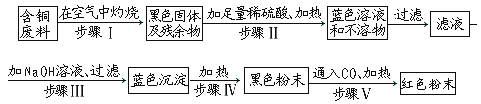
��1��д�����в����еĻ�ѧ����ʽ��������_________������V��_________��
��2�����������γɵ���ɫ��Һ�е�������_________��
��3�����������п�����ɿ�����Ⱦ�IJ�����_________��
��4������ͭ���ϵ�����Ϊaǧ�ˣ���ɫ��ĩ������bǧ�ˣ���ú�ͭ�����еĺ�ͭ��Ϊ��___________���ú�a,b�Ĵ���ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������е�һ����������巢����Ӧ��xA(g)+yB(g)![]() zC(g),ƽ��ʱ���A��Ũ��Ϊ0.40 mol��L-1�������¶Ȳ��䣬���������ݻ���СΪԭ����һ�룬�ٴ�ƽ��ʱ�����A��Ũ������Ϊ0.70 mol��L-1�������й��ж���ȷ���ǣ� ��
zC(g),ƽ��ʱ���A��Ũ��Ϊ0.40 mol��L-1�������¶Ȳ��䣬���������ݻ���СΪԭ����һ�룬�ٴ�ƽ��ʱ�����A��Ũ������Ϊ0.70 mol��L-1�������й��ж���ȷ���ǣ� ��
A. x+y>z B. ƽ�����淴Ӧ�����ƶ�
C. B��ת���ʼ�С D. C�����������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɴ��ϳ�ʹ������ȼ�ϵ�أ���缫�ܷ�ӦʽΪ��2H2+O2��2H2O�����������ҺΪKOH��Һ��������������ȷ���ǣ�
A. �˵���ܼ���dz��ɫ���� B. H2Ϊ������O2Ϊ����
C. ����ʱ���Һ��OH�������ʵ����������� D. �缫��Ӧ�У� H2ʧ���ӣ� O2�õ���
���𰸡�D
��������A���õ����������ȼ�գ����Բ��ܼ���dz��ɫ���棬A����B����ԭ����У�������ͨ��������������ͨ��������B����C����ط�ӦʽΪ��2H2+O2=2H2O�����ݷ���ʽ֪���������Һ�����������ӵ����ʵ������䣬C����D�������ϵ缫��ӦʽΪ��2H2+4OH--4e-��4H2O�������ϵ缫��ӦʽΪ��O2+2H2O+4e-��4OH-�����Ը���������ʧ���ӣ������������õ��ӣ�D��ȷ����ѡD��
�㾦�����⿼��ȼ�ϵ�أ���ȷ�������ϵ�ʧ�����ǽⱾ��ؼ����ѵ��ǵ缫��Ӧʽ����д���缫��Ӧʽ����дҪ��ϵ������Һ������ԣ���ʱ����Ҫ���ǽ���Ĥ�Լ��Dz������ڵĵ���ʵȡ�
�����͡���ѡ��
��������
21
����Ŀ�����淴ӦaA��g��+bB��s��cC��g��+dD��g���������������䣬C�����ʵ����������¶ȣ�T����ѹǿ��P����ϵ��ͼ��������ȷ���� ������ ��
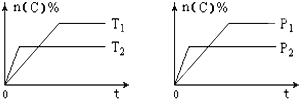
A. P1 > P2
B. �÷�Ӧ����H < 0
C. ��ѧ����ʽϵ��a��c+d
D. ʹ�ô�����C�����ʵ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����д����������ݣ�
��1���ڳ����£������Ϊ VaL��pH Ϊ a ��ϡ��������Ϊ VbL��pHΪ b ���ռ���Һ��ϣ������û��ҺΪ���ԡ���� a+b=15���� Va��Vb=_______��ij�¶�ʱ��ˮ�����ӻ����� Kw=1��10-13���ڴ��¶��£��� pH=a ��������Һ VaL�� pH=b�� NaOH ��Һ VbL ��ϣ������û��ҺΪ���ԣ���� a+b=12���� Va��Vb=_______��
��2���к���ͬ�������ͬ pH �� Ba(OH)2��NH3��H2O��NaOH ����ϡ��Һ������ͬŨ�ȵ����������ֱ�Ϊ V1��V2��V3�������ֹ�ϵΪ______________(�á�V1��V2��V3���͡�>��<��=����ʾ)��
��3�������½� 0.2mol/LHCl ��Һ�� 0.2mol/LMOH ��Һ�������ϣ����Ի�Ϻ���Һ����ı仯������û����Һ�� pH=6���Իش��������⣺
��0.2mol/LHCl ��Һ����ˮ������� c��H+��______0.2mol/LMOH ��Һ����ˮ�������c��H+�����������������������=����
����������Һ��������ʽ�ľ�ȷ����������������֣���c��Cl-��-c��M+��=_______mol/L��
����֪ Ksp��CaCO3����2.8��10��9mol2��L��2�� �ֽ� CaCl2 ��Һ�� 0.02 mol��L��1Na2CO3 ��Һ�������ϣ����� CaCO3 ����ʱ������ CaCl2 ��Һ����С���ʵ���Ũ��Ϊ______mol/L��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com