
| 错误原因 | |
| 改正方法 | |
| 对实验结果的影响 |
| 质量 | 实验前 | 实验后 |
| 药品+U形管的质量/g | 101.1 | 102.9 |
| 药品+广口瓶D的质量/g | 312.0 | 314.2 |
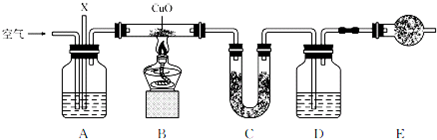
| 错误原因 | 加热前没有除去度本实验有影响的水蒸气 |
| 改正方法 | 在A、B 之间加一个盛浓硫酸的洗气瓶或盛无水CaCl2(或P2O5、碱石灰、固体NaOH等)的干燥管 |
| 对实验结果的影响 | 对实验结果的影响是CH两种元素的质量比偏小 |


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
235 92 |
238 92 |
235 92 |
238 92 |
238 92 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3?H2O电离达到平衡的标志是溶液呈电中性 | ||
B、
| ||
| C、氨水促进了水的电离 | ||
D、c(NH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 CO2和CH4都是要削减的温室气体.
CO2和CH4都是要削减的温室气体.| 反应时间 | 0 | 5 | 10 | 12 |
| CH4/mol?L-1 | 8.0 | 6.5 | 5.5 | 4.0 |
| CO2/mol?L-1 | 6.0 | 4.5 | 3.5 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
| 1 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

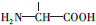 b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、SiO2与干冰的晶体结构相似 |
| B、SiO2耐腐蚀,不与任何酸反应 |
| C、工业上用SiO2制备粗硅 |
| D、光纤主要成分是SiO2,具有导电性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com