
【题目】中国是最早发现并使用青铜器的国家。司母戊鼎是迄今为止出土的世界上最大、最重的青铜礼器,享有“镇国之宝”的美誉(如图1)。

(1)Cu原子的外围电子排布式为_______。
(2)图2所示为第四周期某主族元素的第一至五电离能数据,该元素是_______,I3远大于I2的原因是_______。
(3)图3是某含铜配合物的晶体结构示意图。
①晶体中H2O和SO42-的中心原子的杂化类型为_______,试判断H2O和SO42-的键角大小关系并说明原因_______。
②图3中的氢键有(H2O)O—H···O(H2O)和_______。
③写出该配合物的化学式_______。
(4)一种铜的氯化物晶胞结构如下图所示。

该化合物的化学式为_______,已知P、Q、R的原子坐标分别(0,0,0)、(1,1,1)、 (![]() ,
,![]() ,
,![]() ),若Cu原子与最近的Cl原子的核间距为a pm,则该晶体的密度计算表达式为_______。
),若Cu原子与最近的Cl原子的核间距为a pm,则该晶体的密度计算表达式为_______。
【答案】 3d104s1 Ca(或钙) Ca原子失去2个电子以后达到稳定结构,再失去1个电子很困难 sp3、sp3 H2O分子键角小于的SO42-键角,因为H2O中O存在2对孤电子对而SO42-中的S不存在,孤电子对成键电子的斥力大于成键电子对成键电子的斥力 (H2O)O—H···O(SO42-) [Cu(H2O)4]SO4·H2O CuCl ![]()
![]() g/cm3
g/cm3
【解析】(1)Cu为第29号元素,原子的外围电子排布式为:3d104s1 ;
(2)根据图示第四周期某主族元素的第一至五电离能数据,电离能突变在第三电离能,故该元素为第四周期第IIA族元素,该元素是Ca;I3远大于I2的原因是Ca原子失去2个电子以后达到稳定结构,再失去1个电子很困难;
(3)①晶体中H2O和SO42-的价层电子对数均为4对,故中心原子的杂化类型均为sp3;H2O的键角小于SO42-的键角,因为H2O中O存在2对孤电子对而SO42-中的S没有孤对电子,孤电子对成键电子的斥力大于成键电子对成键电子的斥力,故键角更小;
②图3中的氢键有(H2O)O—H···O(H2O)和(H2O)O—H···O(SO42-);
③该配合物中,中心离子是Cu2+,配体是水,配位数是4,阴离子是硫酸根,还有一个结晶水,故其化学式为:[Cu(H2O)4]SO4·H2O;
(4)铜的氯化物晶胞结构中Cu占据了顶点和面心,Cl占据了体内4个位置,故该化合物的化学式为CuCl,已知P、Q、R的原子坐标分别(0,0,0)、(1,1,1)、 (![]() ,
,![]() ,
,![]() ),若Cu原子与最近的Cl原子的核间距为a pm,即为体对角线的四分之一,故则该晶体的边长为:
),若Cu原子与最近的Cl原子的核间距为a pm,即为体对角线的四分之一,故则该晶体的边长为:![]() ×10-10cm,该晶胞的体积为:
×10-10cm,该晶胞的体积为:![]() ×10-30cm3,一个晶胞的质量为:
×10-30cm3,一个晶胞的质量为:![]() g,故晶胞的密度计算表达式为:
g,故晶胞的密度计算表达式为: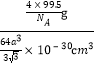 =
= ![]()
![]() g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】下列物质按照单质,氧化物,混合物分类正确的是( )
A. 氧气、 水、 硫酸 B. 氢气、二氧化碳、盐酸
C. 空气,水, 稀硫酸 D. 空气,二氧化碳,稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用粗硅作原料,熔融盐电解法制取硅烷原理如图。下列叙述正确的是

A. 电源的B极为负极
B. 可选用石英代替粗硅
C. 电解时,熔融盐中Li+向粗硅移动
D. 阳极反应:Si+4H--4e-= SiH4↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
A. 氢氧化钠与盐酸;氢氧化钠与醋酸
B. Na2CO3溶液与盐酸;CaCO3与盐酸
C. BaCl2溶液与Na2SO4溶液;BaCl2溶液与NaHSO4溶液
D. Fe(OH)3胶体的制备;Fe(OH)3沉淀的制备
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关NaHCO3和Na2CO3的下列叙述中错误的是( )
①等质量的NaHCO3和Na2CO3分别与足量盐酸反应,Na2CO3产生的CO2多
②84 g NaHCO3、106 g Na2CO3分别与足量的盐酸完全反应,Na2CO3消耗盐酸的物质的量是NaHCO3的两倍
③将澄清石灰水分别倒入两种盐溶液中,只有Na2CO3溶液中产生白色沉淀
④通常状况下,相同温度下,Na2CO3的溶解度大于NaHCO3
A. ①② B. ②③ C. ②④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g) + 3B(g) 2C(g) + 2D(g) 在四种不同情况下的反应速率分别为:① ![]() 、 ②
、 ② ![]() 、 ③
、 ③ ![]() 、④
、④ ![]() ,该反应进行的快慢顺序为
,该反应进行的快慢顺序为
A. ①>③=②>④ B. ①>②=③>④ C. ②>①=④>③ D. ①>④>②=③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段.如图是硫元素的常见化合价与部分物质类别的对应关系:

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______(填化学式).
(2)将X与Y混合,可生成淡黄色固体.该反应中氧化剂与还原剂的物质的量之比为_______.
(3)检验物质Y的方法是_______________________________.
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______.
(5)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号).
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr207氧化为Na2SO4则24mL 0.05molL﹣1的Na2SO3溶液与 20mL 0.02molL﹣1的溶液恰好反应时,Cr元素在还原产物中的化合价为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种理想的绿色能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。乙醇水蒸气重整制氢的部分反应过程如下图所示:
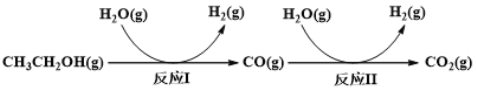
已知:反应I和反应II的平衡常数随温度变化曲线如下图所示。
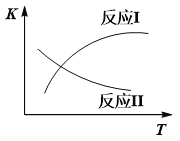
(1)①试说明反应Ⅰ能否发生自发反应______________________________________。
②反应Ⅰ、Ⅱ达平衡后,若在恒温恒压条件下,向体系中充入N2,CO的体积分数会________________(填“上升”、“不变”、“下降”)。
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO的平衡转化率见下图1

(各点对应的反应温度可能相同,也可能不同)。
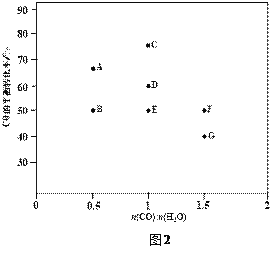
③图中D、E两点对应的反应温度分别为TD和TE。判断:TD______TE(填“<”“=”或“>”)。
④经分析计算,A、E和G三点对应的反应温度相同,理由是_________________________。
⑤在图2中,画出D点所对应温度下CO平衡转化率随进气比[n(CO) : n(H2O)]的曲线。____________
⑥以熔融Na2CO3为电解质的乙醇燃料电池具有广泛的应用,写出其负极的电极反应方程式。________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com