
【题目】氢气是一种理想的绿色能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。乙醇水蒸气重整制氢的部分反应过程如下图所示:
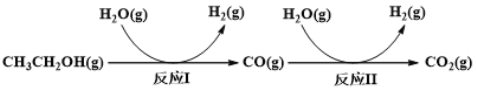
已知:反应I和反应II的平衡常数随温度变化曲线如下图所示。
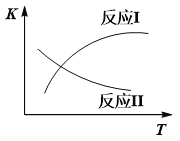
(1)①试说明反应Ⅰ能否发生自发反应______________________________________。
②反应Ⅰ、Ⅱ达平衡后,若在恒温恒压条件下,向体系中充入N2,CO的体积分数会________________(填“上升”、“不变”、“下降”)。
(2)反应II,在进气比[n(CO) : n(H2O)]不同时,测得相应的CO的平衡转化率见下图1

(各点对应的反应温度可能相同,也可能不同)。
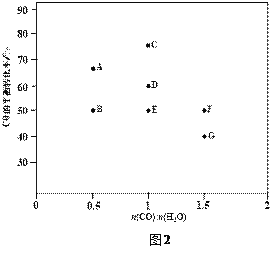
③图中D、E两点对应的反应温度分别为TD和TE。判断:TD______TE(填“<”“=”或“>”)。
④经分析计算,A、E和G三点对应的反应温度相同,理由是_________________________。
⑤在图2中,画出D点所对应温度下CO平衡转化率随进气比[n(CO) : n(H2O)]的曲线。____________
⑥以熔融Na2CO3为电解质的乙醇燃料电池具有广泛的应用,写出其负极的电极反应方程式。________________________________。
【答案】 反应ⅠCH3CH2OH+H2O→2CO+4H2 ,△S>0,根据化学平衡常数与温度的关系可知△H>0 ,高温下可自发 上升 < 经计算,A、E、G三点平衡常数相同,故反应温度相同 趋势正确,且必须穿过F、G之间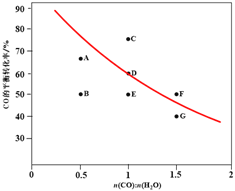 C2H5OH - 6e- + 3CO32- = 5CO2 + 3H2O
C2H5OH - 6e- + 3CO32- = 5CO2 + 3H2O
【解析】(1)①反应ⅠCH3CH2OH+H2O→2CO+4H2 ,△S>0,根据化学平衡常数与温度的关系可知△H>0 ,高温下可自发。
②在恒温恒压条件下,向体系中充入N2相当于增大了容器的体积,有利于反应Ⅰ正向移动,反应II平衡不移动,CO的体积分数会增大。
(2)③已知CO(g)+H2O(g)CO2(g)+H2(g) △H=42kJmol1,反应为放热反应,升温平衡逆向进行,CO转化率减小,图中D.E两点对应的反应温度分别为TD和TE.D点CO转化率大于E点CO转化率,说明TD<TE,故答案为:<;
④E点平衡常数CO(g)+H2O(g)CO2(g)+H2(g)
起始量1100
变化量0.50.50.50.5
平衡量0.50.50.50.5
K=1
A点平衡常数CO(g)+H2O(g)CO2(g)+H2(g)
起始量1200
变化23232323
平衡13432323
K=1
G点平衡常数CO(g)+H2O(g)CO2(g)+H2(g)
起始量3200
变化量1.21.21.21.2
平衡量1.80.8121.2
K=1.2×1.2/1.8×0.8=1,
经计算,A、E、G三点平衡常数相同,故反应温度相同
⑤趋势正确,且必须穿过F、G之间
⑥负极为乙醇失电子的反应,电极反应为:C2H5OH - 6e- + 3CO32- = 5CO2 + 3H2O


科目:高中化学 来源: 题型:
【题目】中国是最早发现并使用青铜器的国家。司母戊鼎是迄今为止出土的世界上最大、最重的青铜礼器,享有“镇国之宝”的美誉(如图1)。

(1)Cu原子的外围电子排布式为_______。
(2)图2所示为第四周期某主族元素的第一至五电离能数据,该元素是_______,I3远大于I2的原因是_______。
(3)图3是某含铜配合物的晶体结构示意图。
①晶体中H2O和SO42-的中心原子的杂化类型为_______,试判断H2O和SO42-的键角大小关系并说明原因_______。
②图3中的氢键有(H2O)O—H···O(H2O)和_______。
③写出该配合物的化学式_______。
(4)一种铜的氯化物晶胞结构如下图所示。

该化合物的化学式为_______,已知P、Q、R的原子坐标分别(0,0,0)、(1,1,1)、 (![]() ,
,![]() ,
,![]() ),若Cu原子与最近的Cl原子的核间距为a pm,则该晶体的密度计算表达式为_______。
),若Cu原子与最近的Cl原子的核间距为a pm,则该晶体的密度计算表达式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质或离子检验的叙述正确的是
A. 在溶液中加酸化的BaCl2溶液,出现白色沉淀,证明原溶液中有SO![]()
B. 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,证明该溶液一定是钠盐溶液
C. 气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气
D. 将气体通入澄清石灰水,溶液变浑浊,证明原气体是SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,密闭容器中发生反应N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ/mol。下列说法正确的是
2NH3(g) △H=-92.4 kJ/mol。下列说法正确的是
A. 将1.0 mol N2、3.0 mol H2置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B. 上述反应达平衡后,若容积不变,再充入1.0 mol氦气,N2的转化率提高
C. 上述反应在达到平衡后,缩小容积增大压强,H2的转化率提高
D. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A. 该溶液的pH=4
B. 升高温度,溶液的pH增大
C. 此酸溶液的KW=1.0×10-14 mol2·L2-
D. 若HB+NaA=HA+NaB能进行,则Ka(HB)>Ka(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物N是一种用于合成γ-分泌调节剂的药物中间体,其合成路线流程图如下:

(1)H的结构简式为______________________。
(2)下列有关说法错误的是________________。
A.G在一定条件下既能与酸反应,又能与碱反应
B. C能发生银镜反应
C.F→G的反应类型是取代反应
D.有机物N的分子式为C13H15NO5
(3)写出D→E的化学方程式:_________________________。
(4)写出同时满足下列条件的G的所有同分异构体的结构简式:____________________。
①含有苯环,核磁共振显示分子中只有四类氢
②能发生水解反应,且1mol该物质与NaOH溶液反应时最多可消耗2molNaOH
(5)丙烯A经过加成、氧化两步反应可合成C,请写出其合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:

下列叙述错误的是
A. 合理处理废旧电池有利于保护环境和资源再利用
B. 从“正极片”中可回收的金属元素有Al、Fe、Li
C. “沉淀”反应的金属离子为Fe3+
D. 上述流程中可用硫酸钠代替碳酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,aLHCl溶于1000g水中,得到的盐酸密度为bg·mL-1,则该盐酸浓度是:
A.a/22.4 mol·L-1
B.ab/22400 mol·L-1
C.ab/(22400+36.5) mol·L-1
D.1000ab/(22400+36.5a) mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属粉末的混合物52g,溶于足量的稀硫酸中,生成标准状况下的氢气22.4L,则这种混合物不可能是( )
A. Na和K B. Mg和Al C. Cu和Al D. Al和Fe
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com