
ЁОЬтФПЁПФГЮТЖШЯТЃЌУмБеШнЦїжаЗЂЩњЗДгІN2(g)ЃЋ3H2(g)![]() 2NH3(g) ЁїHЃНЃ92.4 kJ/molЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
2NH3(g) ЁїHЃНЃ92.4 kJ/molЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. НЋ1.0 mol N2ЁЂ3.0 mol H2жУгк1 LУмБеШнЦїжаЗЂЩњЗДгІЃЌЗХГіЕФШШСПЮЊ92.4 kJ
B. ЩЯЪіЗДгІДяЦНКтКѓЃЌШєШнЛ§ВЛБфЃЌдйГфШы1.0 molКЄЦјЃЌN2ЕФзЊЛЏТЪЬсИп
C. ЩЯЪіЗДгІдкДяЕНЦНКтКѓЃЌЫѕаЁШнЛ§діДѓбЙЧПЃЌH2ЕФзЊЛЏТЪЬсИп
D. Щ§ИпЮТЖШЃЌЦНКтЯђФцЗДгІЗНЯђвЦЖЏЃЌЫЕУїФцЗДгІЫйТЪдіДѓЃЌе§ЗДгІЫйТЪМѕаЁ
ЁОД№АИЁПC
ЁОНтЮіЁП
AЁЂШШЛЏбЇЗНГЬЪНN2(g)ЃЋ3H2(g) ![]() 2NH3(g) ЁїHЃНЃ92.4 kJ/molЃЌБэЪО1molЕЊЦјгы3molЧтЦјЗДгІЩњГЩ2molАБЦј,ЗХГіЕФШШСПЮЊ92.4kJ,вђЮЊПЩФцЗДгІЗДгІЮяВЛФмЭъШЋзЊЛЏ,1.0molЕЊЦјЁЂ3molЧтЦј,жУгк1LУмБеШнЦїжаЗЂЩњЗДгІ,ЗХГіЕФШШСПаЁгк92.4kJ,ЙЪAДэЮѓЃЛBЁЂЩЯЪіЗДгІДяЦНКтКѓЃЌШєШнЛ§ВЛБфЃЌдйГфШы1.0 molКЄЦјЃЌвђКЄЦјЪЧЖшадЦјЬхЃЌжЛИФБфШнЦїЕФзмбЙЃЌЖјN2ЁЂH2ЁЂNH3ЕФЗжбЙВЛЛсИФБфЃЌЫљвдВЛЛсгАЯьЛЏбЇЦНКтвЦЖЏЃЌN2ЕФзЊЛЏТЪВЛБфЃЌЙЪBДэЮѓЃЛCЁЂдіДѓбЙЧПЦНКтЯђЦјЬхЬхЛ§МѕаЁЕФЗНЯђвЦЖЏ,МДЯђе§ЗДгІвЦЖЏ,H2ЕФзЊЛЏТЪЬсИп,ЫљвдCе§ШЗЃЛDЁЂЩ§ИпЮТЖШе§ЁЂФцЗДгІЫйТЪЖМдіДѓЃЌЦНКтЯђЮќШШЗНЯђвЦЖЏЃЌN2(g)ЃЋ3H2(g)
2NH3(g) ЁїHЃНЃ92.4 kJ/molЃЌБэЪО1molЕЊЦјгы3molЧтЦјЗДгІЩњГЩ2molАБЦј,ЗХГіЕФШШСПЮЊ92.4kJ,вђЮЊПЩФцЗДгІЗДгІЮяВЛФмЭъШЋзЊЛЏ,1.0molЕЊЦјЁЂ3molЧтЦј,жУгк1LУмБеШнЦїжаЗЂЩњЗДгІ,ЗХГіЕФШШСПаЁгк92.4kJ,ЙЪAДэЮѓЃЛBЁЂЩЯЪіЗДгІДяЦНКтКѓЃЌШєШнЛ§ВЛБфЃЌдйГфШы1.0 molКЄЦјЃЌвђКЄЦјЪЧЖшадЦјЬхЃЌжЛИФБфШнЦїЕФзмбЙЃЌЖјN2ЁЂH2ЁЂNH3ЕФЗжбЙВЛЛсИФБфЃЌЫљвдВЛЛсгАЯьЛЏбЇЦНКтвЦЖЏЃЌN2ЕФзЊЛЏТЪВЛБфЃЌЙЪBДэЮѓЃЛCЁЂдіДѓбЙЧПЦНКтЯђЦјЬхЬхЛ§МѕаЁЕФЗНЯђвЦЖЏ,МДЯђе§ЗДгІвЦЖЏ,H2ЕФзЊЛЏТЪЬсИп,ЫљвдCе§ШЗЃЛDЁЂЩ§ИпЮТЖШе§ЁЂФцЗДгІЫйТЪЖМдіДѓЃЌЦНКтЯђЮќШШЗНЯђвЦЖЏЃЌN2(g)ЃЋ3H2(g) ![]() 2NH3(g) ЁїHЃНЃ92.4 kJ/molЃЌЪЧЗХШШЗДгІЃЌФцЗДгІЫйТЪБШНЯе§ЗДгІЫйТЪдіДѓИќЖр,ЙЪDДэЮѓЃЛЙЪД№АИбЁCЁЃ
2NH3(g) ЁїHЃНЃ92.4 kJ/molЃЌЪЧЗХШШЗДгІЃЌФцЗДгІЫйТЪБШНЯе§ЗДгІЫйТЪдіДѓИќЖр,ЙЪDДэЮѓЃЛЙЪД№АИбЁCЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУДжЙшзїдСЯЃЌШлШкбЮЕчНтЗЈжЦШЁЙшЭщдРэШчЭМЁЃЯТСаа№Ъіе§ШЗЕФЪЧ

A. ЕчдДЕФBМЋЮЊИКМЋ
B. ПЩбЁгУЪЏгЂДњЬцДжЙш
C. ЕчНтЪБЃЌШлШкбЮжаLi+ЯђДжЙшвЦЖЏ
D. бєМЋЗДгІЃКSiЃЋ4HЃЃ4eЃ= SiH4Ёќ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПРћгУдЊЫиЕФЛЏКЯМлЭЦВтЮяжЪЕФаджЪЪЧЛЏбЇбаОПЕФживЊЪжЖЮЃЎШчЭМЪЧСђдЊЫиЕФГЃМћЛЏКЯМлгыВПЗжЮяжЪРрБ№ЕФЖдгІЙиЯЕЃК

ЃЈ1ЃЉДгСђдЊЫиЛЏКЯМлБфЛЏЕФНЧЖШЗжЮіЃЌЭМжаМШгабѕЛЏадгжгаЛЙдадЕФЛЏКЯЮяга_______ЃЈЬюЛЏбЇЪНЃЉЃЎ
ЃЈ2ЃЉНЋXгыYЛьКЯЃЌПЩЩњГЩЕЛЦЩЋЙЬЬхЃЎИУЗДгІжабѕЛЏМСгыЛЙдМСЕФЮяжЪЕФСПжЎБШЮЊ_______ЃЎ
ЃЈ3ЃЉМьбщЮяжЪYЕФЗНЗЈЪЧ_______________________________ЃЎ
ЃЈ4ЃЉZЕФХЈШмвКгыЭЕЅжЪдквЛЖЈЬѕМўЯТПЩвдЗЂЩњЛЏбЇЗДгІЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_______ЃЎ
ЃЈ5ЃЉNa2S2O3ЪЧживЊЕФЛЏЙЄдСЯЃЎДгбѕЛЏЛЙдЗДгІЕФНЧЖШЗжЮіЃЌЯТСажЦБИNa2S2O3ЕФЗНАИРэТлЩЯПЩааЕФЪЧ______ЃЈЬюДњКХЃЉЃЎ
aЃЎNa2S+S bЃЎNa2SO3+S cЃЎSO2+Na2SO4 dЃЎNa2SO3+Na2SO4
ЃЈ6ЃЉвбжЊNa2SO3ФмБЛK2Cr207бѕЛЏЮЊNa2SO4дђ24mL 0.05molLЉ1ЕФNa2SO3ШмвКгы 20mL 0.02molLЉ1ЕФШмвКЧЁКУЗДгІЪБЃЌCrдЊЫидкЛЙдВњЮяжаЕФЛЏКЯМлЮЊ________ЃЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈжае§ШЗЕФЪЧ
A. зуСПЕФKIШмвКгыFeCl3ШмвКЗДгІКѓЃЌгУCCl4нЭШЁЦфжаЕФI2ЃЌЗжвКЃЌдкЫЎШмвКжаЕЮМгKSCNШмвКШдГЪбЊКьЩЋЃЌЫЕУїИУЗДгІгавЛЖЈЕФЯоЖШ
B. дквЛЖЈЬѕМўЯТЃЌвЛЗнЫЋбѕЫЎбљЦЗОЙ§2 hЃЌH2O2ЕФХЈЖШДг0.05 molЁЄLЃ1ЯТНЕЕН0.03 molЁЄLЃ1ЃЌH2O2дкет2 hжаЗжНтЕФЦНОљЗДгІЫйТЪдМЮЊ0.015 molЁЄLЃ1ЁЄhЃ1
C. ЦфЫћЬѕМўЯрЭЌЪБЃЌЗДгІЮТЖШЩ§ИпЃЌЖдгкЮќШШЗДгІЃЌЗДгІЫйТЪМгПьЃЌЖдгкЗХШШЗДгІЃЌЗДгІЫйТЪМѕТ§
D. вЛЖЈЬѕМўЯТЃЌЙЬЖЈЬхЛ§ЕФШнЦїжаЗЂЩњЗДгІA(g)ЃЋB(g) ![]() 2C(g)ЃЌЕБШнЦїФкAЁЂBЁЂCЕФХЈЖШжЎБШЮЊ1ЁУ1ЁУ2ЪБЃЌИУЗДгІДІгкЦНКтзДЬЌ
2C(g)ЃЌЕБШнЦїФкAЁЂBЁЂCЕФХЈЖШжЎБШЮЊ1ЁУ1ЁУ2ЪБЃЌИУЗДгІДІгкЦНКтзДЬЌ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПpH=aЕФФГЕчНтжЪШмвКжаЃЌВхШыСНжЇЖшадЕчМЋЃЌЭЈжБСїЕчвЛЖЮЪБМфКѓЃЌШмвКЕФpHЃОaЃЌдђИУЕчНтжЪПЩФмЪЧ
A. Na2SO4 B. H2SO4 C. AgNO3 D. NaCl
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЪЕбщВйзїжаДэЮѓЕФЪЧ
A. ЗжвКЪБЃЌЗжвКТЉЖЗЯТВувКЬхДгЯТПкЗХГіЃЌЩЯВувКЬхДгЩЯПкЕЙГі
B. еєСѓЪБ,гІЪЙЮТЖШМЦЫЎвјЧђППНќеєСѓЩеЦПжЇЙмПк
C. CO2жаЛьгаЩйСПHClЦјЬхПЩгУБЅКЭЬМЫсФЦШмвКГ§ШЅ
D. гУеєСѓЕФЗНЗЈПЩНЋЦћгЭКЭУКгЭНјааЗжРы
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЧтЦјЪЧвЛжжРэЯыЕФТЬЩЋФмдДЁЃРћгУЩњЮяжЪЗЂНЭЕУЕНЕФввДМжЦШЁЧтЦјЃЌОпгаСМКУЕФгІгУЧАОАЁЃввДМЫЎеєЦјжиећжЦЧтЕФВПЗжЗДгІЙ§ГЬШчЯТЭМЫљЪОЃК
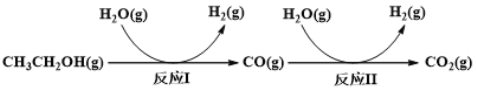
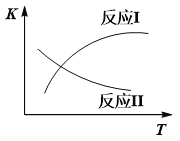
вбжЊЃКЗДгІIКЭЗДгІIIЕФЦНКтГЃЪ§ЫцЮТЖШБфЛЏЧњЯпШчЯТЭМЫљЪОЁЃ
ЃЈ1ЃЉЂйЪдЫЕУїЗДгІЂёФмЗёЗЂЩњздЗЂЗДгІ______________________________________ЁЃ
ЂкЗДгІЂёЁЂЂђДяЦНКтКѓЃЌШєдкКуЮТКубЙЬѕМўЯТЃЌЯђЬхЯЕжаГфШыN2ЃЌCOЕФЬхЛ§ЗжЪ§Лс________________ЃЈЬюЁАЩЯЩ§ЁБЁЂЁАВЛБфЁБЁЂЁАЯТНЕЁБЃЉЁЃ
ЃЈ2ЃЉЗДгІIIЃЌдкНјЦјБШ[n(CO) : n(H2O)]ВЛЭЌЪБЃЌВтЕУЯргІЕФCOЕФЦНКтзЊЛЏТЪМћЯТЭМ1

ЃЈИїЕуЖдгІЕФЗДгІЮТЖШПЩФмЯрЭЌЃЌвВПЩФмВЛЭЌЃЉЁЃ
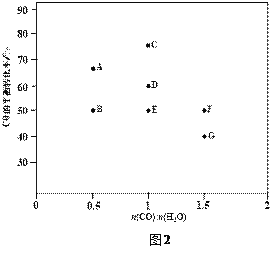
ЂлЭМжаDЁЂEСНЕуЖдгІЕФЗДгІЮТЖШЗжБ№ЮЊTDКЭTEЁЃХаЖЯЃКTD______TEЃЈЬюЁА<ЁБЁА=ЁБЛђЁА>ЁБЃЉЁЃ
ЂмОЗжЮіМЦЫуЃЌAЁЂEКЭGШ§ЕуЖдгІЕФЗДгІЮТЖШЯрЭЌЃЌРэгЩЪЧ_________________________ЁЃ
ЂндкЭМ2жаЃЌЛГіDЕуЫљЖдгІЮТЖШЯТCOЦНКтзЊЛЏТЪЫцНјЦјБШ[n(CO) : n(H2O)]ЕФЧњЯпЁЃ____________
ЂовдШлШкNa2CO3ЮЊЕчНтжЪЕФввДМШМСЯЕчГиОпгаЙуЗКЕФгІгУЃЌаДГіЦфИКМЋЕФЕчМЋЗДгІЗНГЬЪНЁЃ________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊpAgЃЋ= -lgc(AgЃЋ)ЃЌpXЃ= -lgc(XЃ)ЁЃФГЮТЖШЯТЃЌAgBrЁЂAgIдкЫЎжаЕФГСЕэШмНтЦНКтЧњЯпШчЭМЫљЪОЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ

A. aКЭcСНЕуЕФKWЯрЭЌ
B. KSP(AgCl)=1.0ЁС10Ѓ14 mol2ЁЄLЃ2
C. ЯђБЅКЭAgClШмвКжаМгШыNaClЙЬЬхЃЌПЩЪЙaЕуБфЕНdЕу
D. AgCl(s)ЃЋBrЃ(aq)![]() AgBr (s)ЃЋClЃ(aq)ЦНКтГЃЪ§ЃЫ= KSP(AgCl)/ KSP(AgBr)
AgBr (s)ЃЋClЃ(aq)ЦНКтГЃЪ§ЃЫ= KSP(AgCl)/ KSP(AgBr)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЪЕбщЯжЯѓУшЪіе§ШЗЕФЪЧ(ЁЁЁЁ)
бЁЯю | ЪЕ бщ | Яж Яѓ |
A | ЯђБЅКЭNa2CO3ШмвКжаЭЈШызуСПЕФCO2ЦјЬх | ЮоУїЯдЯжЯѓ |
B | дкОЦОЋЕЦЩЯМгШШТСВ | ТСВШлЛЏЃЌЪЇШЅЙтдѓЃЌШлЛЏЕФТСВЕЮТфЯТРД |
C | ЯђОУжУгкПеЦјжаЕФFeSO4ШмвКжаЕЮМгNaOHШмвК | СЂПЬВњЩњДѓСПАзЩЋГСЕэ |
D | МгШШЗХдклсліжаЕФаЁПщФЦ | ФЦЯШШлЛЏГЩЙтССЕФаЁЧђЃЌШМЩеЪБЛ№бцЮЊЛЦЩЋЃЌШМЩеКѓЩњГЩЕЛЦЩЋЙЬЬх |
A. A B. B C. C D. D
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com