
【题目】如下图的转化关系,A是一种红褐色的金属氧化物,B是一种非金属单质,H是一中难溶于水的白色化合物。
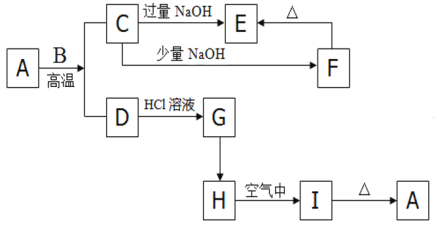
请回答下列问题:
(1)请写出下列物质的化学式:A________;F________;
(2)按要求写出下列离子方程式或化学方程式
A + B :_________________________________________________;
F → E:_____________________________________________________;
D → G:_____________________________________________(离子方程式);
(3)检验G中所含阳离子的方法是___________________________________________;
【答案】Fe2O3 NaHCO3 Fe2O3 + 3C == 2Fe + 3CO2↑ 2NaHCO3 = Na2CO3 + H2O + CO2↑ Fe + 2H+ = Fe2+ + H2↑ 加入KSCN无明显现象,再加入新制氯水,溶液变为血红色或加入NaOH,先产生白色沉淀,后变为灰绿色,最终变为红褐色
【解析】
A是一种红褐色的金属氧化物,所以A是Fe2O3,B是一种非金属单质,在高温下能和Fe2O3反应,说明B是碳;Fe2O3 + 3C ![]() 2 + 3CO2↑,则D为Fe,G为FeCl2, H是一中难溶于水的白色化合物,则H是Fe(OH)2,在空气中氧化为Fe(OH)3,则I为Fe(OH)3,加热2Fe(OH)3
2 + 3CO2↑,则D为Fe,G为FeCl2, H是一中难溶于水的白色化合物,则H是Fe(OH)2,在空气中氧化为Fe(OH)3,则I为Fe(OH)3,加热2Fe(OH)3![]() Fe2O3+3H2O;C为CO2,通人过量的NaOH溶液, CO2+2NaOH= Na2CO3 + H2O
Fe2O3+3H2O;C为CO2,通人过量的NaOH溶液, CO2+2NaOH= Na2CO3 + H2O
通人少量的NaOH溶液:H2O+ CO2+NaOH= NaHCO3 ,则E 为Na2CO3、F为NaHCO3。
(1)综合上述分析物质A的化学式:Fe2O3,物质F的化学式NaHCO3;答案:Fe2O3,NaHCO3。
(2)下列离子方程式或化学方程式:A + B : Fe2O3 + 3C ![]() 2 + 3CO2↑;
2 + 3CO2↑;
F → E:2NaHCO3 = Na2CO3 + H2O + CO2↑ D → G:Fe + 2H+ = Fe2+ + H2↑;
(3)G为FeCl2,检验G中所含Fe2+阳离子为的方法;加入KSCN无明显现象,再加入新制氯水,溶液变为血红色或加入NaOH,先产生白色沉淀,后变为灰绿色,最终变为红褐色
。


 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】室温下,分别向两杯100mL的水中逐渐加入少量NH4Cl和NaOH固体,溶液的pH变化如图所示。下列判断正确的是
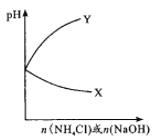
A. X代表NaOH,Y代表NH4Cl
B. pH变化相同时,n(NH4Cl)<n(NaOH)
C. 两份溶液的Kw均大于1.0×10-14
D. 若两杯溶液混合后呈中性,则加入的n(NH4Cl)和n(NaOH)不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合溶液中逐渐通入CO2气体至过量,生成沉淀的物质的量(n)和通入CO2气体的(V) 的关系如图所示,试回答:

(1)0到a点之间的反应的离子方程式__________
(2)a到b点之间的反应的离子方程式__________
(3)b点之后的反应的离子方程式______________
(4)c 点CO2的体积__________mL(同温同压下)。
(5) 混合溶液中Ba(OH)2和NaOH 的物质的量之比为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是高炉炼铁的示意图。已知反应:

①2Fe2O3(s)+3C(s)![]() 4Fe(s)+3CO2(g) ΔH1=+468kJ/mol
4Fe(s)+3CO2(g) ΔH1=+468kJ/mol
②C(s)+CO2(g)![]() 2CO(g) ΔH2=+172.7 kJ/mol
2CO(g) ΔH2=+172.7 kJ/mol
(1)反应 ③Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH3=_________
2Fe(s)+3CO2(g) ΔH3=_________
(2)高炉炼铁中,存在可逆反应,增大高炉高度,能否减少尾气中CO排放比例?____(填“能”或“否”);能够减小高炉尾气中CO排放比例的措施是_______(举出一条)。
(3)一定温度下,某容器中加人足量的Fe2O3和C,发生反应:2Fe2O3(s)+3C(s)![]() 4Fe(s)+3CO2(g),达到平衡,下列说法错误的是_________(填序号)。
4Fe(s)+3CO2(g),达到平衡,下列说法错误的是_________(填序号)。
A.将容积压缩为原来的一半,再次达平衡时,CO2的浓度为原来的2倍
B. 向容器中再加Fe2O3,可以提高反应的速率
C.将体积变为原来的2倍,再次达平衡时,气体的密度不变
D.保持容器体积不变,充入He,平衡逆向移动
(4)为了消除CO对空气的污染,常温下将CO通入PdCl2的水溶液中,将其转化为无毒的气体并得到Pd单质。反应的化学方程式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个容积均为1L的恒温恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下发生反应3CO(g)+3H2(g)![]() (CH3)2O(g)+CO2(g)(不发生其他反应),CO的平衡转化率与温度和压强的关系加下图所示。
(CH3)2O(g)+CO2(g)(不发生其他反应),CO的平衡转化率与温度和压强的关系加下图所示。
容器 | 起始物质的量/mol | 平衡 转化率 | |||
CO | H2 | (CH3)2O | CO2 | CO | |
Ⅰ | 0.3 | 0.3 | 0 | 0 | 50% |
Ⅱ | 0.3 | 0.3 | 0 | 0.1 | |
Ⅲ | 0 | 0 | 0.2 | 0.4 | |

下列说法正确的是( )
A. 该反应的△H<0,图中压强p1>p2
B. 达到平衡时,容器Ⅱ中CO的平衡转化率大于50%
C. 达到平衡时,容器Ⅰ与容器Ⅱ的总压强之比小于4∶5
D. 达到平衡时,容器Ⅲ中n[(CH3)2O]是容器Ⅱ中的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4是实验室常用的氧化剂,可用作水处理剂等。
(1)实验室用MnO2等为原料制取少量KMnO4的实验流程如下:

①“熔融”时,可用作坩埚材质的是__________ (填序号)。
a.氧化铝 b.陶瓷 c.铁 d.玻璃
②“K2MnO4歧化”的离子方程式为__________。
③“蒸发浓缩”时,温度需控制在80℃,适宜的加热方式是__________。
(2)高锰酸钾法测定水体COD(化学雷氧量)的实验步骤如下:
步骤1.准确移取100mL水样,置于250mL锥形瓶中。加入10mL1∶3的硫酸,再加入15.00mL0.0200mol·L-1KMnO4溶液(此时溶液仍呈紫红色)。
步骤2.用小火煮沸10min(水中还原性物质被MnO4-氧化,本身还原为Mn2+),取下锥形瓶趁热加10.00mL0.0500mol·L-1Na2C2O4溶液,充分振荡(此时溶液为无色)。
步骤3.趁热用0.0200 mol·L-1KMnO4溶液滴定至呈微红色,消耗KMnO4溶液4.500mL。通过计算确定该水样的化学需氧量(写出计算过程)。__________________[已知:COD是指在一定条件下,以氧化1L水样中还原性物质所消耗的氧化剂的量,通常换算为需要的O2的质量(mg),COD的单位mg·L-1。]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为常见玻璃仪器组成的六种实验装置,根据需婴加入液体或者固体试剂。下列说法错误的是

A. 装有P2O5固体的E不能用于干燥氨气
B. A、B装置能用于收集Cl2,又能用于收集NO
C. C、D装置可以用于尾气处理,能防止液体倒吸到气体发生装置中
D. F 装置可用于合成氨实验中,若装入浓硫酸可以干燥、混合并能大致观察H2和N2的体积比
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com