
【题目】如图所示是高炉炼铁的示意图。已知反应:

①2Fe2O3(s)+3C(s)![]() 4Fe(s)+3CO2(g) ΔH1=+468kJ/mol
4Fe(s)+3CO2(g) ΔH1=+468kJ/mol
②C(s)+CO2(g)![]() 2CO(g) ΔH2=+172.7 kJ/mol
2CO(g) ΔH2=+172.7 kJ/mol
(1)反应 ③Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH3=_________
2Fe(s)+3CO2(g) ΔH3=_________
(2)高炉炼铁中,存在可逆反应,增大高炉高度,能否减少尾气中CO排放比例?____(填“能”或“否”);能够减小高炉尾气中CO排放比例的措施是_______(举出一条)。
(3)一定温度下,某容器中加人足量的Fe2O3和C,发生反应:2Fe2O3(s)+3C(s)![]() 4Fe(s)+3CO2(g),达到平衡,下列说法错误的是_________(填序号)。
4Fe(s)+3CO2(g),达到平衡,下列说法错误的是_________(填序号)。
A.将容积压缩为原来的一半,再次达平衡时,CO2的浓度为原来的2倍
B. 向容器中再加Fe2O3,可以提高反应的速率
C.将体积变为原来的2倍,再次达平衡时,气体的密度不变
D.保持容器体积不变,充入He,平衡逆向移动
(4)为了消除CO对空气的污染,常温下将CO通入PdCl2的水溶液中,将其转化为无毒的气体并得到Pd单质。反应的化学方程式为____________
【答案】 -25.05kJ/mol 否 增加进风口的O2含量 AB D CO+PdCl2+H2O=CO2+Pd↓+2HCl
【解析】(1)已知:
①2Fe2O3(s)+3C(s)![]() 4Fe(s)+3CO2(g) ΔH1=+468kJ/mol
4Fe(s)+3CO2(g) ΔH1=+468kJ/mol
②C(s)+CO2(g)![]() 2CO(g) ΔH2=+172.7 kJ/mol
2CO(g) ΔH2=+172.7 kJ/mol
根据盖斯定律可知(①-②×3)/2即可得到反应③Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的反应热ΔH3=-25.05kJ/mol;(2)增大高炉高度,平衡不移动,因此不能减少尾气中CO排放比例;CO与氧气反应生成CO2,所以要减小高炉尾气中CO排放比例应该增加进风口的O2含量;(4)A.将容积压缩为原来的一半,压强增大,平衡向体积减小的逆反应方向进行,因此再次达平衡时,CO2的浓度小于原来的2倍,A错误;B. 氧化铁是固体,向容器中再加氧化铁,反应速率不变,B错误;C.由于体系中只有二氧化碳一种气体,所以将体积变为原来的2倍再次达平衡时,气体的密度不变,C正确;D.保持容器体积不变,充入He,压强增大,但二氧化碳的浓度不变,所以平衡不移动,D错误,答案选ABD;(4)为了消除CO对空气的污染,常温下将CO通入PdCl2的水溶液中将其转化为无毒的气体并得到Pd单质,无毒的气体是CO2,所以反应的化学方程式为CO+PdCl2+H2O=CO2+Pd↓+2HCl。
2Fe(s)+3CO2(g)的反应热ΔH3=-25.05kJ/mol;(2)增大高炉高度,平衡不移动,因此不能减少尾气中CO排放比例;CO与氧气反应生成CO2,所以要减小高炉尾气中CO排放比例应该增加进风口的O2含量;(4)A.将容积压缩为原来的一半,压强增大,平衡向体积减小的逆反应方向进行,因此再次达平衡时,CO2的浓度小于原来的2倍,A错误;B. 氧化铁是固体,向容器中再加氧化铁,反应速率不变,B错误;C.由于体系中只有二氧化碳一种气体,所以将体积变为原来的2倍再次达平衡时,气体的密度不变,C正确;D.保持容器体积不变,充入He,压强增大,但二氧化碳的浓度不变,所以平衡不移动,D错误,答案选ABD;(4)为了消除CO对空气的污染,常温下将CO通入PdCl2的水溶液中将其转化为无毒的气体并得到Pd单质,无毒的气体是CO2,所以反应的化学方程式为CO+PdCl2+H2O=CO2+Pd↓+2HCl。


科目:高中化学 来源: 题型:
【题目】近年来,人类生产、生活所产生的污染使灰霾天气逐渐增多。灰霾粒子的平均直径在1000nm~2000nm。下列有关说法正确的是
A. 灰霾可能来自汽车尾气 B. 灰霾属于胶体
C. 灰霾形成的是非常稳定的体系 D. 戴口罩不能阻止呼入灰霾粒子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向恒容容器中充入amolH2和amolI2蒸气,发生反应H2(g)+I2(g)![]() 2HI(g).下列能判断该反应达到平衡状态的是
2HI(g).下列能判断该反应达到平衡状态的是
A. 混合气体的平均分子质量不再发生改变
B. 每断裂1molH-H键的同时就生成2molI-H键
C. 容器中混合气体的颜色不变
D. H2和I2的体积分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中发生的化学反应属于加成反应的是( )
A.用光照射甲烷与氯气的混合气体
B.将乙烯通入溴的四氯化碳溶液中
C.乙醇和酸性重铬酸钾溶液的反应
D.甲烷在空气中完全燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,1L恒容密闭容器中发生反应:2A(g)+B(g)![]() C(g) ΔH。其他条件不变,改变起始A和B的投料比得到如图所示关系。下列说法错误的是
C(g) ΔH。其他条件不变,改变起始A和B的投料比得到如图所示关系。下列说法错误的是
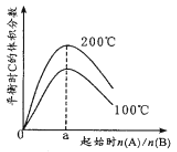
A. n(A)/n(B)=2时,A和B的转化率相等 B. ΔH<0
C. a=2 D. 相同温度下,平衡常数与起始投料比无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图的转化关系,A是一种红褐色的金属氧化物,B是一种非金属单质,H是一中难溶于水的白色化合物。
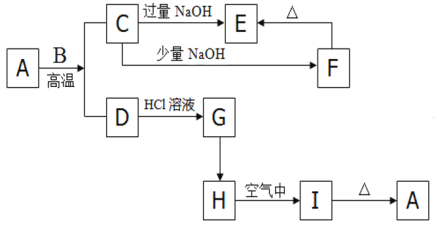
请回答下列问题:
(1)请写出下列物质的化学式:A________;F________;
(2)按要求写出下列离子方程式或化学方程式
A + B :_________________________________________________;
F → E:_____________________________________________________;
D → G:_____________________________________________(离子方程式);
(3)检验G中所含阳离子的方法是___________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为10 L的密闭容器中充入1mol H2和1mol I2,并在一定温度下使其发生反应:H2(g)+I2(g) ![]() 2HI(g)。20min后达到平衡,测得c(HI)=0.04 mol/L。
2HI(g)。20min后达到平衡,测得c(HI)=0.04 mol/L。
(1)反应从开始到平衡时,v(H2)为_______,平衡常数K=__________。
(2)温度不变,达到平衡后向容器中再充入1molHI气体,平衡向________ (填“正向”、“逆向”或“不移动”)移动;再次平衡后,HI的体积分数将________ (填“增大”、“减小”或“不变”)
(3)将(2)所得平衡体系升温,平衡后I2的体积分数为45%,则升温后,H2的转化率将_____(填“增大”、“减小”或“不 变”),该反应的ΔH_____0(填“>”、“ <”或“=”)。
(4)结合(3)请画出2HI(g)![]() H2(g)+I2(g)的平衡常数K随温度变化的趋势图。
H2(g)+I2(g)的平衡常数K随温度变化的趋势图。
 _____
_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰、砷、镓及其相关化合物用途非常广泛。
(1)Mn2+基态核外电子排布式为__________。
(2)砷与镓、硒是同周期的主族元素,其第一电离能从小到大的顺序是__________。
(3)BrCH2CN可用于制备砷叶立德,BrCH2CN分子中碳原子杂化轨道类型是__________。
(4)在AlCl3存在下,将C2H2通入AsCl3可得到(ClCH=CH)2AsCl等物质,AsCl3分子的几何构型为__________,1mol(ClCH=CH)2AsCl分子中含σ键的数目为__________。
(5)GaAs是一种重要的半导体材料,按图示掺杂锰后可得稀磁性半导体材料(晶体结构不变),则该材料晶体中n(Ga) ∶n(Mn) ∶n(As)=__________。
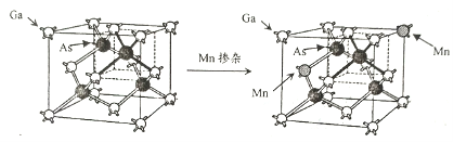
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】上海世博园地区的一座大型钢铁厂搬迁后,附近居民将不再受到该厂产生的棕红色烟的困扰。你估计这一空气污染物是因为含有( )
A.FeO粉尘B.Fe2O3粉尘C.Fe粉尘D.碳粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com