
【题目】一定温度下,1L恒容密闭容器中发生反应:2A(g)+B(g)![]() C(g) ΔH。其他条件不变,改变起始A和B的投料比得到如图所示关系。下列说法错误的是
C(g) ΔH。其他条件不变,改变起始A和B的投料比得到如图所示关系。下列说法错误的是
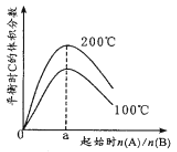
A. n(A)/n(B)=2时,A和B的转化率相等 B. ΔH<0
C. a=2 D. 相同温度下,平衡常数与起始投料比无关
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】在三个密闭容器中分别充入氦气、氧气、氮气,当它们的温度和密度都相同时,这三种气体的压强(P)从大到小的顺序是( )
A.氦气>氧气>氮气
B.氧气>氮气>氦气
C.氧气>氦气>氮气
D.氦气>氮气>氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲测定铁铝合金的组成,将铁铝合金溶解后,取试样25.00mL,分离并测定Fe3+的浓度,实验方案设计如下:

已知:乙醚易挥发,易燃烧。
回答下列问题:
(1)常温下,将铁铝合金溶解的试剂是_________(填字母)。
a.稀盐酸 b.稀硫酸 c.稀硝酸 d.浓硝酸
(2)已知氢氧化铁实际上是三氧化二铁的水合物,则通过称量氢氧化铁固体质量的方法来确定c(Fe3+)时,该方案理论上的主要缺点是________________________。
(3)操作X是___________________________,操作X后检验溶液中是否有Fe3+残留的方法是_______________________________。
(4)蒸馏装置如图所示,装置中存在的错误是___________________________。

(5)将含Fe3+的溶液定容至100mL需要的仪器是___________________________。
(6)已知滴定反应为Ce4++Fe2+=Ce3++Fe3+,当滴定达到终点时,消耗0.1000 mol·L-1Ce(SO4)2溶液15.00 mL,则开始试样中c(Fe3+)=_____________。若改用稀硫酸酸化的K2Cr2O7溶液滴定含Fe2+的待测液,则该过程的离子反应方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超氧化钾KO2也和过氧化钠一样,吸收CO2变成碳酸盐并放出O2 . 若有0.5molKO2与过量CO2反应,则产生O2的物质的量为( )
A.0.125mol
B.0.375mol
C.0.5mol
D.0.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由化合物X、Y为起始原料可合成药物Z。下列说法正确的是( )
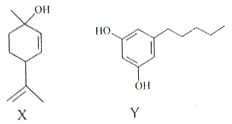
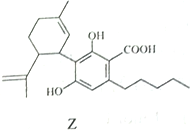
A. X分子中所有碳原子可处于同一平面 B. X、Z分子中均含有2个手性碳原子
C. 1molZ最多只能与2molBr2发生反应 D. X、Y、Z均可与NaOH稀溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是高炉炼铁的示意图。已知反应:

①2Fe2O3(s)+3C(s)![]() 4Fe(s)+3CO2(g) ΔH1=+468kJ/mol
4Fe(s)+3CO2(g) ΔH1=+468kJ/mol
②C(s)+CO2(g)![]() 2CO(g) ΔH2=+172.7 kJ/mol
2CO(g) ΔH2=+172.7 kJ/mol
(1)反应 ③Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH3=_________
2Fe(s)+3CO2(g) ΔH3=_________
(2)高炉炼铁中,存在可逆反应,增大高炉高度,能否减少尾气中CO排放比例?____(填“能”或“否”);能够减小高炉尾气中CO排放比例的措施是_______(举出一条)。
(3)一定温度下,某容器中加人足量的Fe2O3和C,发生反应:2Fe2O3(s)+3C(s)![]() 4Fe(s)+3CO2(g),达到平衡,下列说法错误的是_________(填序号)。
4Fe(s)+3CO2(g),达到平衡,下列说法错误的是_________(填序号)。
A.将容积压缩为原来的一半,再次达平衡时,CO2的浓度为原来的2倍
B. 向容器中再加Fe2O3,可以提高反应的速率
C.将体积变为原来的2倍,再次达平衡时,气体的密度不变
D.保持容器体积不变,充入He,平衡逆向移动
(4)为了消除CO对空气的污染,常温下将CO通入PdCl2的水溶液中,将其转化为无毒的气体并得到Pd单质。反应的化学方程式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、下列可用于分离和提纯物质的方法是
(1)除去CaO中混有的CaCO3颗粒____
(2)分离CCl4和水的混合物_____
(3)分离溴水中的溴和水______
(4)除去澄清石灰水中悬浮的CaCO3颗粒______
II、掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

(1)写出下列仪器的名称:①_____________④______________
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器____________;进行I分离操作时进水口为______(填f或g)。
(3)现需配制500mL 0.2 mol/L NaOH溶液,其中装置II是该同学转移溶液的示意图,该同学操作的错误是 _______________;_____________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ca10(PO4)6(OH)2(羟基磷酸钙,简写HAP)是一种新型的环境功能矿物材料,可用于除去水体中的F-、Cd2+、Pb2+及Cu2+等。
(1)制备HAP的步骤如下:分别配制250mL浓度均为0.5 mol·L-1的Ca(NO3)2溶液和(NH4)2HPO4溶液(pH约为8),按n(Ca)/n(P)=1.67分别量取相应体积的溶液,加热至50℃,不断搅拌下,按特定的方式加料,强力搅拌1h,再经后续处理得到产品。
①特定的加料方式是__________ (填序号)。
a.将Ca(NO3)2溶液逐滴滴入(NH4)2HPO4溶液中,再用氨水调节pH至10.5
b.将(NH4)2HPO4溶液逐滴滴入Ca(NO3)2溶液中,再用氨水调节pH至10.5
c.将(NH4)2HPO4溶液和氨水混合并调节pH至10.5,再滴入Ca(NO3)2溶液
②反应生成Ca10(PO4)6(OH)2的离子方程式为__________。
(2)HAP脱除F-的操作是:在聚四氟乙烯烧杯中加入50mL10mg·L-1NaF溶液和0.15gCa10(PO4)6(OH)2,在恒温下振荡,每隔1h测定一次溶液中F-浓度,直至达到吸附平衡。
①实验中“烧杯”材质用“聚四氟乙烯”塑料而不用玻璃,其原因是__________。
②除氟反应形式之一是:Ca10(PO4)6(OH)2+20F-![]() 10CaF2+6PO43-+2OH-,该反应的平衡常数K=__________[用Ksp(CaF2)和Ksp(HAP)表示]。
10CaF2+6PO43-+2OH-,该反应的平衡常数K=__________[用Ksp(CaF2)和Ksp(HAP)表示]。
(3)HAP脱除Pb(Ⅱ)包括物理吸附和溶解-沉淀吸附。物理吸附时,HAP的特定位可吸附溶液中某些阳离子;溶解-沉淀吸附的机理为:
Ca10(PO4)6(OH)2(s)+2H+(aq)![]() 10Ca2+(aq)+6PO43-(aq)+2H2O(l)(溶解)
10Ca2+(aq)+6PO43-(aq)+2H2O(l)(溶解)
10Pb2+(aq)+6PO43-(aq)+2H2O(l)![]() Pb10(PO4)6(OH)2(s)+2H+(aq)(沉淀)
Pb10(PO4)6(OH)2(s)+2H+(aq)(沉淀)
已知Pb(Ⅱ)的分布分数如图-1所示;一定条件下HAP对Pb(1)平衡吸附量与pH的关系如图-2所示。
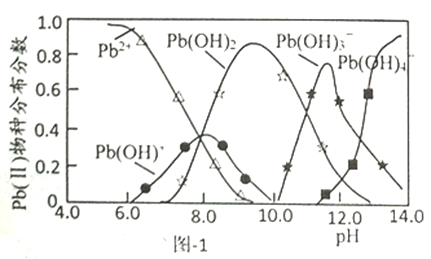
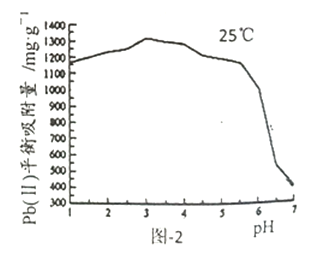
①能使甲基橙显红色的Pb(Ⅱ)溶液中滴入少量NaOH至溶液呈中性,该过程中主要反应的离子方程式为__________。
②当pH<3.0时,pH越小HAP对Pb(Ⅱ)平衡吸附量稍减小,其原因是__________。
③当pH>7.0时,生成的沉淀为__________(填化学式);此时pH越大HAP对Pb(Ⅱ)平衡吸附量越小,其原因是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com