
【题目】在含有较多NH4+、Ba2+、NO3-、Cl-的溶液中还能大量共存的离子是
A. Ag+ B. Mg2+ C. SO42- D. OH-
科目:高中化学 来源: 题型:
【题目】一定温度下,1L恒容密闭容器中发生反应:2A(g)+B(g)![]() C(g) ΔH。其他条件不变,改变起始A和B的投料比得到如图所示关系。下列说法错误的是
C(g) ΔH。其他条件不变,改变起始A和B的投料比得到如图所示关系。下列说法错误的是
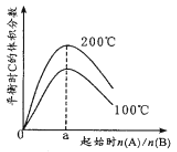
A. n(A)/n(B)=2时,A和B的转化率相等 B. ΔH<0
C. a=2 D. 相同温度下,平衡常数与起始投料比无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. Fe-Cu-CuSO4溶液组成的原电池中负极反应式为:Fe —3e—= Fe3+
B. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O = HClO+HSO
C. 向FeCl3溶液中加入适量小苏打溶液:Fe3++3HCO3— = Fe(OH)3↓+3CO2↑
D. 电解AgNO3溶液的总反应式:4Ag+ + OH— = 4Ag+O2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据元素周期律,碳的非金属性强于硅,请用一个化学反应方程式表示___________________。
(2)若FeSO4和O2的系数比为2∶1,试配平下列方程式:
![]() FeSO4+
FeSO4+![]() K2O2→
K2O2→![]() K2FeO4+
K2FeO4+![]() K2O+
K2O+![]() K2SO4+
K2SO4+![]() O2↑ __________________
O2↑ __________________
(3)各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氮氧化物(NOx)废气的方法之一是用NaOH溶液进行吸收,现有NO与NO2的混合气体,将其通入50 mL 2 mol/L的NaOH溶液中,恰好完全吸收,测得溶液中含有NO3- 0.02 mol。
①所得溶液中NaNO2的物质的量为________ mol;
②混合气体中V(NO)∶V(NO2)=________。
(4)As2O3俗称砒霜,As2O3是两性偏酸性氧化物,是亚砷酸(H3AsO3)的酸酐,易溶于碱生成亚砷酸盐,写出As2O3与足量氢氧化钠溶液反应的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,其原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)常温下X、Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是___。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。该化合物溶液浓度为0.1 mol/L时, pH最接近_____。
A.5.6 B.7.0 C.8.4 D.13.0
(3)在一个装有可移动活塞的恒温容器中进行如下反应:C2(g)+3A2(g)![]() 2CA3(g) ΔH<0,反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2 mol,此时总容积为1.0 L。
2CA3(g) ΔH<0,反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2 mol,此时总容积为1.0 L。
①达此平衡前各物质起始的量如下,其中不合理的是_______________;
A.C2 0.6mol, A2 0.5mol, CA3 0mol
B.C2 0mol, A2 0mol, CA3 1.2mol
C.C2 0.55mol,A2 0.35mol,CA3 0.1mol
D.C2 0.8mol,A2 1.1mol,CA3 0mol
②此平衡体系的平衡常数K=____________________;
③如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将_________(填“正向”、“逆向”或“不”)移动。
(4)已知常温常压下,0.5mol B2A2与足量的D2反应,生成BD2和液态A2D,放出649.8 kJ 的热量。写出B2A2燃烧热的热化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】上海世博园地区的一座大型钢铁厂搬迁后,附近居民将不再受到该厂产生的棕红色烟的困扰。你估计这一空气污染物是因为含有( )
A.FeO粉尘B.Fe2O3粉尘C.Fe粉尘D.碳粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,H2A是一种易溶于水的二元酸,将NaOH溶液滴入等物质的量浓度的H2A溶液中,溶液中H2A、HA-、A2-的物质的量分数(a)随溶液pH的变化关系如图所示。下列说法错误的是

A. 常温下,H2A![]() HA-+H+的电离平衡常数Ka1=10-3.30
HA-+H+的电离平衡常数Ka1=10-3.30
B. 当c(Na+)=2c(A2-)+c(HA-)时,溶液呈中性
C. pH=6.27时,c(A2-)=c(HA-)>c(H+)>c(OH-)
D. V(NaOH溶液):V(HA溶液)=3:2时,2c(Na+)+c(OH-)=2c(H2A)+c(HA-)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氯乙烯(PVC)保鲜膜的安全问题引起广泛关注。PVC的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。工业上用乙烯和氯气为原料经下列各步合成PVC:
![]()
(1)乙是PVC的单体,其结构简式为_____________________;
(2)反应①的化学方程式为______________________________________________________;
(3)写出以下反应类型:反应②_________________;反应③_________________。
(4)邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸( )是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酯,请写出DMP的结构简式为________________。
)是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酯,请写出DMP的结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及H2O、Cr2O72-、NO2-、H+、NO3-、Cr3+六种微粒,已知反应过程中NO3-浓度变化如图所示,且氧化剂和还原剂的物质的量之比为1∶3,下列判断错误的是( )
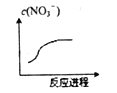
A. Cr2O72-中Cr化合价是+6 价 B. 反应的氧化产物是NO3-
C. 消耗1mol氧化剂,转移电子6mol D. 反应中Cr3+被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com