
【题目】常温下,H2A是一种易溶于水的二元酸,将NaOH溶液滴入等物质的量浓度的H2A溶液中,溶液中H2A、HA-、A2-的物质的量分数(a)随溶液pH的变化关系如图所示。下列说法错误的是

A. 常温下,H2A![]() HA-+H+的电离平衡常数Ka1=10-3.30
HA-+H+的电离平衡常数Ka1=10-3.30
B. 当c(Na+)=2c(A2-)+c(HA-)时,溶液呈中性
C. pH=6.27时,c(A2-)=c(HA-)>c(H+)>c(OH-)
D. V(NaOH溶液):V(HA溶液)=3:2时,2c(Na+)+c(OH-)=2c(H2A)+c(HA-)+c(H+)
【答案】D
【解析】分析:A项,根据电离平衡常数表达式和点(3.30,0.5)计算Ka1;B项,根据电荷守恒判断;C项,根据点(6.27,0.5)和图像判断;D项,用电荷守恒、物料守恒判断。
详解:A项,H2A![]() H++HA-的电离平衡常数Ka1=
H++HA-的电离平衡常数Ka1=![]() ,当c(HA-)=c(H2A)时溶液的pH=3.30即溶液中c(H+)=10-3.30,代入Ka1=10-3.30,A项正确;B项,NaOH滴入H2A溶液中,溶液中的电荷守恒为c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),当c(Na+)=c(HA-)+2c(A2-)时,c(H+)=c(OH-),溶液呈中性,B项正确;C项,根据图像pH=6.27时,溶液中c(A2-)=c(HA-),溶液呈酸性,c(H+)
,当c(HA-)=c(H2A)时溶液的pH=3.30即溶液中c(H+)=10-3.30,代入Ka1=10-3.30,A项正确;B项,NaOH滴入H2A溶液中,溶液中的电荷守恒为c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),当c(Na+)=c(HA-)+2c(A2-)时,c(H+)=c(OH-),溶液呈中性,B项正确;C项,根据图像pH=6.27时,溶液中c(A2-)=c(HA-),溶液呈酸性,c(H+)![]() c(OH-),C项正确;D项,NaOH滴入H2A溶液中,溶液中的电荷守恒为c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),NaOH溶液和H2A溶液物质的量浓度相等,当V(NaOH溶液):V(H2A溶液)=3:2时,溶液中的物料守恒为2c(Na+)=3[c(H2A)+c(HA-)+c(A2-)],将两式整理得,
c(OH-),C项正确;D项,NaOH滴入H2A溶液中,溶液中的电荷守恒为c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),NaOH溶液和H2A溶液物质的量浓度相等,当V(NaOH溶液):V(H2A溶液)=3:2时,溶液中的物料守恒为2c(Na+)=3[c(H2A)+c(HA-)+c(A2-)],将两式整理得, ![]() c(Na+)+c(OH-)=2c(H2A)+c(HA-)+c(H+),D项错误;答案选D。
c(Na+)+c(OH-)=2c(H2A)+c(HA-)+c(H+),D项错误;答案选D。


科目:高中化学 来源: 题型:
【题目】I、下列可用于分离和提纯物质的方法是
(1)除去CaO中混有的CaCO3颗粒____
(2)分离CCl4和水的混合物_____
(3)分离溴水中的溴和水______
(4)除去澄清石灰水中悬浮的CaCO3颗粒______
II、掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

(1)写出下列仪器的名称:①_____________④______________
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器____________;进行I分离操作时进水口为______(填f或g)。
(3)现需配制500mL 0.2 mol/L NaOH溶液,其中装置II是该同学转移溶液的示意图,该同学操作的错误是 _______________;_____________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为10 mL、物质的量浓度相同的两份NaOH 溶液中分别通入一定量的CO2,得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1mol/L的盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积的关系如图所示。则下列叙述中不正确的是

A. 原NaOH溶液的物质的量浓度为0.5 mol/L
B. 当0盐酸)<10 mL时,甲溶液中发生反应的离子方程式为H++CO32-=HCO3-
C. 乙溶液中含有的溶质是Na2CO3、NaOH
D. 向乙溶液中滴加过量盐酸后产生CO2体积的最大值为224 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备1,2一二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略)。
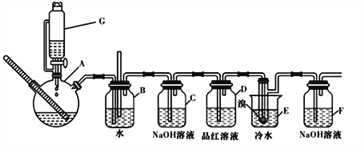
有关数据列表如下:

请按要求回答下列问题:
已知:CH3CH2OH![]() CH2=CH2 ↑+H2O
CH2=CH2 ↑+H2O
(1)G中药品为1:3无水乙醇和浓硫酸混合液,用来制备乙烯,装置G的名称为_____
(2)装置B中长直导管的作用是_____________
(3)反应过程中应用冷水冷却装置E中大试管,但又不能过度冷却(如用冰水),其原因是_____
(4)某学生发现反应结束时,G中试剂消耗量大大超过理论值(装置不漏气),其原因是_____(任写出一种可能的原因)
(5)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,其原因是______
(6)若消耗无水乙醇的体积为100 mL,制得1,2一二溴乙烷的体积为40 mL,则该反应的产率为___(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的相关化合物在生产生活中具有重要的作用。
回答下列问题:
(1)铜元素在周期表中的位置是____,基态铜原子中,核外电子占据最高能层的符号是___,占据该最高能层的电子数为_________。
(2)在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、Cu6Zn8等。某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于___(填“晶体”或”非晶体”)。
(3)铜能与类卤素[(SCN)2]反应生成Cu(SCN)2,1mol(SCN)2分子中含有σ键的数目为_____。
(SCN)2对应的酸有硫氰酸(H-S-C≡N)、异硫氰酸(H-N=C=S)两种,理论上前者沸点低于后者,其原因是__________。
(4)铜晶体中铜原子的堆积方式为面心立方堆积,每个铜原子周围距离最近的铜原子个数为__。
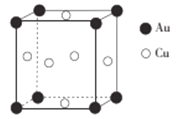
(5)铜与金形成的金属互化物的晶胞结构如图所示,其晶胞边长为anm,该金属互化物的密度为_____________(用含a、NA的代数式表示)g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上由ClO2气体制取NaClO2固体的工艺流程如图所示,下列说法错误的是
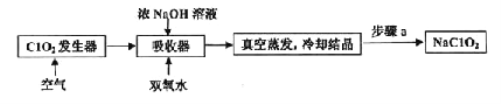
A. 通入的空气可将发生器中产生的ClO2全部驱赶到吸收器中
B. 吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H++O2↑
C. 步骤a的操作包括过滤、洗涤和干燥
D. 工业上将ClO2气体制成NaClO2固体,其主要目的是便于贮存和运输
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com