
【题目】Ca10(PO4)6(OH)2(羟基磷酸钙,简写HAP)是一种新型的环境功能矿物材料,可用于除去水体中的F-、Cd2+、Pb2+及Cu2+等。
(1)制备HAP的步骤如下:分别配制250mL浓度均为0.5 mol·L-1的Ca(NO3)2溶液和(NH4)2HPO4溶液(pH约为8),按n(Ca)/n(P)=1.67分别量取相应体积的溶液,加热至50℃,不断搅拌下,按特定的方式加料,强力搅拌1h,再经后续处理得到产品。
①特定的加料方式是__________ (填序号)。
a.将Ca(NO3)2溶液逐滴滴入(NH4)2HPO4溶液中,再用氨水调节pH至10.5
b.将(NH4)2HPO4溶液逐滴滴入Ca(NO3)2溶液中,再用氨水调节pH至10.5
c.将(NH4)2HPO4溶液和氨水混合并调节pH至10.5,再滴入Ca(NO3)2溶液
②反应生成Ca10(PO4)6(OH)2的离子方程式为__________。
(2)HAP脱除F-的操作是:在聚四氟乙烯烧杯中加入50mL10mg·L-1NaF溶液和0.15gCa10(PO4)6(OH)2,在恒温下振荡,每隔1h测定一次溶液中F-浓度,直至达到吸附平衡。
①实验中“烧杯”材质用“聚四氟乙烯”塑料而不用玻璃,其原因是__________。
②除氟反应形式之一是:Ca10(PO4)6(OH)2+20F-![]() 10CaF2+6PO43-+2OH-,该反应的平衡常数K=__________[用Ksp(CaF2)和Ksp(HAP)表示]。
10CaF2+6PO43-+2OH-,该反应的平衡常数K=__________[用Ksp(CaF2)和Ksp(HAP)表示]。
(3)HAP脱除Pb(Ⅱ)包括物理吸附和溶解-沉淀吸附。物理吸附时,HAP的特定位可吸附溶液中某些阳离子;溶解-沉淀吸附的机理为:
Ca10(PO4)6(OH)2(s)+2H+(aq)![]() 10Ca2+(aq)+6PO43-(aq)+2H2O(l)(溶解)
10Ca2+(aq)+6PO43-(aq)+2H2O(l)(溶解)
10Pb2+(aq)+6PO43-(aq)+2H2O(l)![]() Pb10(PO4)6(OH)2(s)+2H+(aq)(沉淀)
Pb10(PO4)6(OH)2(s)+2H+(aq)(沉淀)
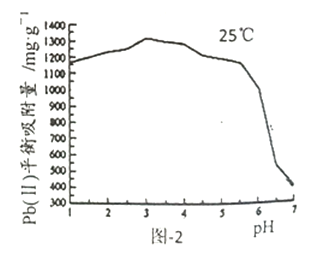
已知Pb(Ⅱ)的分布分数如图-1所示;一定条件下HAP对Pb(1)平衡吸附量与pH的关系如图-2所示。
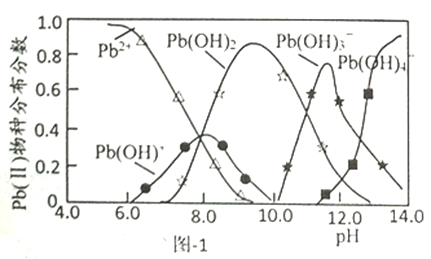
①能使甲基橙显红色的Pb(Ⅱ)溶液中滴入少量NaOH至溶液呈中性,该过程中主要反应的离子方程式为__________。
②当pH<3.0时,pH越小HAP对Pb(Ⅱ)平衡吸附量稍减小,其原因是__________。
③当pH>7.0时,生成的沉淀为__________(填化学式);此时pH越大HAP对Pb(Ⅱ)平衡吸附量越小,其原因是__________。
【答案】 b 10Ca2++6HPO42-+8NH3·H2O![]() Ca10(PO4)6(OH)2↓+8NH4++6H2O 防止F-及其水解生成的HF与玻璃中SiO2反应 Ksp(HAP)/K10sp(CaF2) Pb2++OH-=Pb(OH)+ 溶液中c(H+)大,大量H+占据HAP对Pb2+的吸附位,物理吸附能力减弱 Pb10(PO4)6(OH)2和Pb(OH)2 c(H+)减小,会减少HAP在溶液中的溶解量,便生成的c(PO43-)减小,溶解-沉淀吸附能力减弱且改变了吸附机理
Ca10(PO4)6(OH)2↓+8NH4++6H2O 防止F-及其水解生成的HF与玻璃中SiO2反应 Ksp(HAP)/K10sp(CaF2) Pb2++OH-=Pb(OH)+ 溶液中c(H+)大,大量H+占据HAP对Pb2+的吸附位,物理吸附能力减弱 Pb10(PO4)6(OH)2和Pb(OH)2 c(H+)减小,会减少HAP在溶液中的溶解量,便生成的c(PO43-)减小,溶解-沉淀吸附能力减弱且改变了吸附机理
【解析】(1)①特定的加料方式是将(NH4)2HPO4溶液逐滴滴入Ca(NO3)2溶液中,防止发生双水解而产生磷酸钙等杂质,再用氨水调节pH至10.5,答案选b;②(NH4)2HPO4 、Ca(NO3)2及NH3·H2O反应生成Ca10(PO4)6(OH)2的离子方程式为10Ca2++6HPO42-+8NH3·H2O![]() Ca10(PO4)6(OH)2↓+8NH4++6H2O;(2)①防止F-及其水解生成的HF与玻璃中SiO2反应,故实验中“烧杯”材质用“聚四氟乙烯”塑料而不用玻璃;②反应Ca10(PO4)6(OH)2+20F-
Ca10(PO4)6(OH)2↓+8NH4++6H2O;(2)①防止F-及其水解生成的HF与玻璃中SiO2反应,故实验中“烧杯”材质用“聚四氟乙烯”塑料而不用玻璃;②反应Ca10(PO4)6(OH)2+20F-![]() 10CaF2+6PO43-+2OH-的平衡常数K=
10CaF2+6PO43-+2OH-的平衡常数K=![]() ;(3)①能使甲基橙显红色的Pb(Ⅱ)溶液中滴入少量NaOH至溶液呈中性,该过程中主要反应是Pb2+与OH-反应转化为Pb(OH)+,反应的离子方程式为Pb2++OH-=Pb(OH)+;②当pH<3.0时,pH越小HAP对Pb(Ⅱ)平衡吸附量稍减小,其原因是溶液中c(H+)大,大量H+占据HAP对Pb2+的吸附位,物理吸附能力减弱;③由图中信息可知,当pH>7.0时,生成的沉淀为Pb10(PO4)6(OH)2和Pb(OH)2;此时pH越大HAP对Pb(Ⅱ)平衡吸附量越小,其原因是c(H+)减小,会减少HAP在溶液中的溶解量,便生成的c(PO43-)减小,溶解-沉淀吸附能力减弱且改变了吸附机理。
;(3)①能使甲基橙显红色的Pb(Ⅱ)溶液中滴入少量NaOH至溶液呈中性,该过程中主要反应是Pb2+与OH-反应转化为Pb(OH)+,反应的离子方程式为Pb2++OH-=Pb(OH)+;②当pH<3.0时,pH越小HAP对Pb(Ⅱ)平衡吸附量稍减小,其原因是溶液中c(H+)大,大量H+占据HAP对Pb2+的吸附位,物理吸附能力减弱;③由图中信息可知,当pH>7.0时,生成的沉淀为Pb10(PO4)6(OH)2和Pb(OH)2;此时pH越大HAP对Pb(Ⅱ)平衡吸附量越小,其原因是c(H+)减小,会减少HAP在溶液中的溶解量,便生成的c(PO43-)减小,溶解-沉淀吸附能力减弱且改变了吸附机理。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】“低碳生活”是指改善环境、减少能源消耗、节约资源、减少二氧化碳排放的健康生活方式.下列不符合“低碳生活”的做法是( )
A.“垃圾不落地,台州更美丽”
B.太阳能热水器代替燃气热水器
C.杜绝使用一切燃料
D.环保袋代替一次性塑料袋
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,1L恒容密闭容器中发生反应:2A(g)+B(g)![]() C(g) ΔH。其他条件不变,改变起始A和B的投料比得到如图所示关系。下列说法错误的是
C(g) ΔH。其他条件不变,改变起始A和B的投料比得到如图所示关系。下列说法错误的是
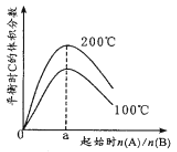
A. n(A)/n(B)=2时,A和B的转化率相等 B. ΔH<0
C. a=2 D. 相同温度下,平衡常数与起始投料比无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为10 L的密闭容器中充入1mol H2和1mol I2,并在一定温度下使其发生反应:H2(g)+I2(g) ![]() 2HI(g)。20min后达到平衡,测得c(HI)=0.04 mol/L。
2HI(g)。20min后达到平衡,测得c(HI)=0.04 mol/L。
(1)反应从开始到平衡时,v(H2)为_______,平衡常数K=__________。
(2)温度不变,达到平衡后向容器中再充入1molHI气体,平衡向________ (填“正向”、“逆向”或“不移动”)移动;再次平衡后,HI的体积分数将________ (填“增大”、“减小”或“不变”)
(3)将(2)所得平衡体系升温,平衡后I2的体积分数为45%,则升温后,H2的转化率将_____(填“增大”、“减小”或“不 变”),该反应的ΔH_____0(填“>”、“ <”或“=”)。
(4)结合(3)请画出2HI(g)![]() H2(g)+I2(g)的平衡常数K随温度变化的趋势图。
H2(g)+I2(g)的平衡常数K随温度变化的趋势图。
 _____
_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用废雷尼镍(主要成分为NiO、Al,少量Cr、Fe、C、S及有机物)制备Ni(NO3)2·6H2O的实验流程如下:
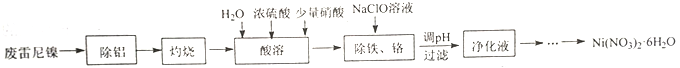
已知:①在实验条件下,Ni2+、Cr3+在溶液中不能被NaClO或HNO3氧化。
②NiSO4易溶于水,NiCO3难溶于水;Ni(NO3)2在20℃、90℃时溶解度依次为79.2、188g/100g水。
③己知“酸溶”后的溶液中主要的四种离子开始沉淀与沉淀完全的pH如下:
Ni2+ | Fe2+ | Fe3+ | Cr3+ | |
开始沉淀pH | 6.2 | 7.6 | 2.3 | 4.5 |
沉淀完全pH | 8.5 | 9.1 | 3.3 | 5.6 |
(1)“除铝”所用试剂及主要操作为__________。
(2)“灼烧”的主要目的是__________。
(3)“酸溶”时,用浓硫酸和水代替稀硫酸的目的是__________。
(4)“除铁、铬”时,Fe2+被氧化为Fe3+的离子方程式为__________;氧化后需将溶液pH调整到的范围是__________。
(5)请设计由“净化液”制取Ni(NO3)2·6H2O的实验方案:__________,离心分离、洗涤、干燥得Ni(NO3)2·6H2O (实验中须使用的试剂有:6mol·L-1硝酸,3 mol·L-1Na2CO3溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰、砷、镓及其相关化合物用途非常广泛。
(1)Mn2+基态核外电子排布式为__________。
(2)砷与镓、硒是同周期的主族元素,其第一电离能从小到大的顺序是__________。
(3)BrCH2CN可用于制备砷叶立德,BrCH2CN分子中碳原子杂化轨道类型是__________。
(4)在AlCl3存在下,将C2H2通入AsCl3可得到(ClCH=CH)2AsCl等物质,AsCl3分子的几何构型为__________,1mol(ClCH=CH)2AsCl分子中含σ键的数目为__________。
(5)GaAs是一种重要的半导体材料,按图示掺杂锰后可得稀磁性半导体材料(晶体结构不变),则该材料晶体中n(Ga) ∶n(Mn) ∶n(As)=__________。
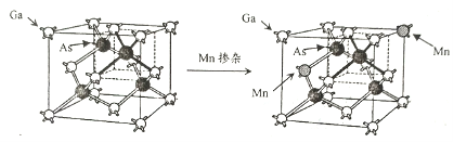
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. Fe-Cu-CuSO4溶液组成的原电池中负极反应式为:Fe —3e—= Fe3+
B. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O = HClO+HSO
C. 向FeCl3溶液中加入适量小苏打溶液:Fe3++3HCO3— = Fe(OH)3↓+3CO2↑
D. 电解AgNO3溶液的总反应式:4Ag+ + OH— = 4Ag+O2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据元素周期律,碳的非金属性强于硅,请用一个化学反应方程式表示___________________。
(2)若FeSO4和O2的系数比为2∶1,试配平下列方程式:
![]() FeSO4+
FeSO4+![]() K2O2→
K2O2→![]() K2FeO4+
K2FeO4+![]() K2O+
K2O+![]() K2SO4+
K2SO4+![]() O2↑ __________________
O2↑ __________________
(3)各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氮氧化物(NOx)废气的方法之一是用NaOH溶液进行吸收,现有NO与NO2的混合气体,将其通入50 mL 2 mol/L的NaOH溶液中,恰好完全吸收,测得溶液中含有NO3- 0.02 mol。
①所得溶液中NaNO2的物质的量为________ mol;
②混合气体中V(NO)∶V(NO2)=________。
(4)As2O3俗称砒霜,As2O3是两性偏酸性氧化物,是亚砷酸(H3AsO3)的酸酐,易溶于碱生成亚砷酸盐,写出As2O3与足量氢氧化钠溶液反应的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氯乙烯(PVC)保鲜膜的安全问题引起广泛关注。PVC的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。工业上用乙烯和氯气为原料经下列各步合成PVC:
![]()
(1)乙是PVC的单体,其结构简式为_____________________;
(2)反应①的化学方程式为______________________________________________________;
(3)写出以下反应类型:反应②_________________;反应③_________________。
(4)邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸( )是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酯,请写出DMP的结构简式为________________。
)是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酯,请写出DMP的结构简式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com