
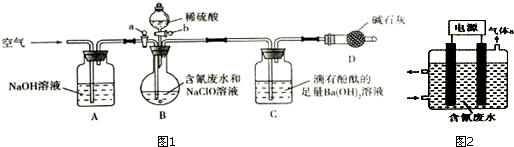
分析 (1)实验的原理是利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定C装置的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰;
(2)滴有酚酞的氢氧化钡溶液呈红色,二氧化碳通入和氢氧化钡反应生成碳酸钡白色沉淀,氢氧根离子浓度减小,溶液红色会逐渐褪去;
(3)反应结束后,缓缓通入空气,可将生成的二氧化碳全部被吸收;
(4)依据反应CN-+ClO-=CNO-+Cl-,2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O,CO2+Ba(OH)2=BaCO3↓+H2O,结合定量关系计算;
(5)通过直接测量装置C反应前后的质量变化,实验中应排除水蒸气、氯气和空气中二氧化碳的干扰,需要除去氯气的洗气装置和对二氧化碳气体干燥的干燥装置;
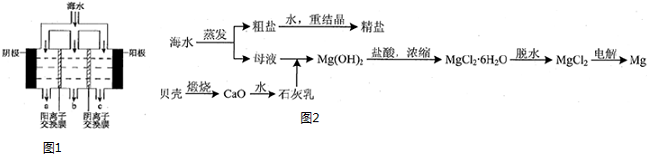
(6)利用如图2所示装置可以除去废水中的CN-.控制溶液PH为5.2--6.8时,CN-转化为C2O42-和NH4+.变化过程是在电解池阳极上CN-失电子发生氧化反应转化为C2O42-和NH4+,阴极上是氢离子得到电子生成氢气.
解答 解:(1)实验的原理是利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰,防止对装置C实验数据的测定产生干扰,装置D的作用是排除空气中二氧化碳对实验的干扰,
故答案为:防止空气中的CO2和水蒸气进入C装置;
(2)滴有酚酞的氢氧化钡溶液呈红色,二氧化碳通入和氢氧化钡反应生成碳酸钡白色沉淀,氢氧根离子浓度减小,溶液红色会逐渐褪去,
故答案为:有白色沉淀生成,溶液的红色逐渐褪色;
(3)反应后装置中残留二氧化碳,应继续通过将净化的空气,将装置内的残留的二氧化碳全部进入装置C并被Ba(OH)2完全吸收,以减少实验误差,
故答案为:将反应产生的CO2全部排入C装置并被Ba(OH)2完全吸收;
(4)依据反应CN-+ClO-=CNO-+Cl-,2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O,CO2+Ba(OH)2=BaCO3↓+H2O得到,装置C中生成39.4mg沉淀为BaCO3↓物质的量=$\frac{39.4×1{0}^{-3}g}{197g/mol}$=2×10-4mol
CN-+~CNO-~CO2~BaCO3↓
1 1
c(CN-)=$\frac{2×1{0}^{-4}mol}{0.1L}$=0.002mol/L,
故答案为:0.002;
(5)通过直接测量装置C反应前后的质量变化,实验中应排除水蒸气、氯气和空气中二氧化碳的干扰,需要除去氯气的洗气装置和对二氧化碳气体干燥的干燥装置,在装置B、C之间依次连接盛有CCl4、浓硫酸的洗气瓶,
故答案为:在装置B、C之间依次连接盛有CCl4、浓硫酸的洗气瓶;
(6)利用如图2所示装置可以除去废水中的CN-.控制溶液PH为5.2--6.8时,CN-转化为C2O42-和NH4+.变化过程是在电解池阳极上CN-失电子发生氧化反应转化为C2O42-和NH4+,阴极上是氢离子得到电子生成氢气;
①分析可知气体a是阴极上氢离子得到电子生成的氢气,
故答案为:H2;
②在电解池阳极上CN-失电子发生氧化反应转化为C2O42-和NH4+,电极反应为:2CN-+4H2O-2e-=C2O42-+2NH4+,
故答案为:2CN-+4H2O-2e-=C2O42-+2NH4+.
点评 本题综合考查物质含量的测定的实验设计,以氯气的性质为载体考查化学实验设计和评价问题,题目难度中等,注意把握实验原理和实验方法.


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:选择题
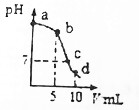 25℃时,向10mL 0.2mol•L-1 NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.已知:Ka(HCN)=6.4×10-10.下列叙述错误的是( )
25℃时,向10mL 0.2mol•L-1 NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.已知:Ka(HCN)=6.4×10-10.下列叙述错误的是( )| A. | a点时,CN-离子浓度大于其他点 | B. | b点时,c(HCN)>c(CN-) | ||
| C. | c点时,c(Na+)=c(Cl-)+c(CN-) | D. | d点时,溶液的c(H+)≈8×10-5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Cl-、Mg2+、NO3- | B. | K+、Cl-、Mg2+、SO42- | ||
| C. | Fe3+、Na+、NO3-、Al3+ | D. | HCO3-、NH4+、Ag+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
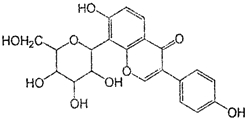
| A. | 该物质在一定条件下能发生消去反应、加成反应、取代反应 | |
| B. | 葛根素的分子式为C21H22O9 | |
| C. | 该物质在一定条件下能与碳酸氢钠溶液反应 | |
| D. | 一定条件下1 mol 该物质与H2反应最多能消耗7 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
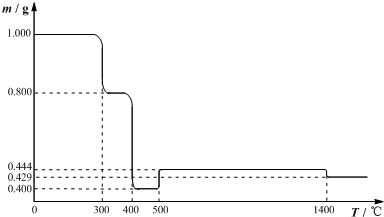
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .固体甲溶于水后,溶液呈碱(酸、碱或中性),写出甲与水反应的化学方程式NH5+H2O=NH3•H2O+H2↑.
.固体甲溶于水后,溶液呈碱(酸、碱或中性),写出甲与水反应的化学方程式NH5+H2O=NH3•H2O+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体.
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,2.24LSO2与O2混合气体中所含氧原子数为0.2NA | |
| B. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 标准状况下,20gD20分子中所含中子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com