
����Ŀ��
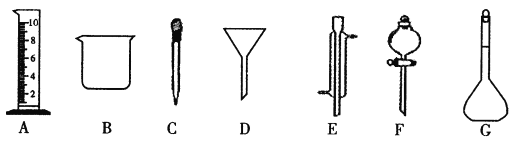
��1��д���������ƣ�E_____________��F_____________��
��2������ʵ��������õ�����D����_________(ѡ������ѡ��ı����ĸ )��
A������ˮ��CC14�Ļ���� B������ˮ�;ƾ��Ļ���� C������ˮ����ɰ�Ļ����
��.ij������ȤС����Ҫ200mL1mol/L��Na2CO3��Һ,��ش��������⣺
��1��������Һ����������ҩƷ��
Ӧ��ȡNa2CO3������ | Ӧѡ������ƿ�Ĺ�� | ������ƿ���Ҫ������������������ͼ�е�______��_____�������� |
��2������ʱ������ȷ�IJ���˳����(����ĸ��ʾ��ÿ������ֻ����һ��)______________��
A��������ȴ����Һ�ز�����ע������ƿ��
B����������ƽȷ��������Na2CO3�������������ձ��У��ټ�������ˮ���ò���������������ʹ���ܽ�(��Ҫʱ�ɼ���)
C��������ˮϴ���ձ�2-3�Σ�ϴ��Һ��ע������ƿ�У���
D�����ý�ͷ�ιܼ�ˮ��ʹ��Һ��Һ��ǡ����̶�������
E.������ƿ�ǽ�����ҡ��
F.����������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�1��2cm��
��3�������������������������ҺŨ�Ƚ��к�Ӱ��(����ƫ��������ƫ����������Ӱ����)?
û�н���C����________��������Һʱ������ƿδ����_________������ʱ���ӿ̶���_________��
���𰸡�I.��1�������ܣ���Һ©������2��c��
II.��1��26.5��250mL��B�����ձ�����C����ͷ�ιܣ���
��2��B��A��C��F��D��E����3��ƫ�ͣ���Ӱ�죬ƫ�ߡ�
������������I. ��1��E���������������ܣ�F �����Ƿ�Һ©������2������D��©����A������ˮ��CC14�����ֻ������ܵ�Һ������Ҫʹ�÷�Һ©��������©��������B�� ˮ�;ƾ��ǻ��ܵ�Һ��������ߵķе㲻ͬ������ˮ�;ƾ��Ļ����Ҫ������ķ�����C�� ��ɳ������ˮ����˷��������ԵĹ�����Һ������ķ����ǹ��ˣ�ʹ�õ�������©������ѡ��c��ȷ����.����200mL1mol/L��Na2CO3��Һ����������ƿ�Ĺ����250mL����Һ������Ũ����ȣ�����n(Na2CO3)=1mol/L��0.25L=0.25mol��m(Na2CO3)= 0.25mol��106g/mol=26.5g��Ӧѡ������ƿ�Ĺ��250mL��������ƿ���Ҫ������������������ͼ�е��ձ�����ͷ�ιܼ�����������ѡ�������B��C����2�� �������ʵ���Ũ�ȵ���Һʱ�����Ʋ�����B����������ƽȷ��������Na2CO3�������������ձ��У��ټ�������ˮ���ò���������������ʹ���ܽ⣻A��������ȴ����Һ�ز�����ע������ƿ�У�C��������ˮϴ���ձ�2-3�Σ�ϴ��Һ��ע������ƿ�У���F.����������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�1��2cm����D�����ý�ͷ�ιܼ�ˮ��ʹ��Һ��Һ��ǡ����̶������У�E.������ƿ�ǽ�����ҡ�ȡ�������B��A��C��F��D��E����3����û�н���C�����������ʵ����ʵ���ƫ�٣�ʹ��Һ��Ũ��ƫ�ͣ�������Һʱ������ƿδ������ڲ�Ӱ�����ʵ����ʵ�������Һ�������������Ƶ���Һ��Ũ����Ӱ�죻����ʱ���ӿ̶��ߣ�����Һ�����ƫ�٣�ʹ��Һ�����ʵ���Ũ��ƫ�ߡ�


 ������ʱͬ����ϰ��ϵ�д�
������ʱͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С��������ͼ��ʾװ�ü���Ũ������ľ̿��Ӧ�ĸ��ֲ��
��ش�
��1��Ũ������ľ̿��Ӧ�Ļ�ѧ����ʽ��______��
��2���Լ�A��______��
��3��Ʒ����Һ��������______��
��4������ʯ��ˮ����ǣ��ܷ�һ��˵�����ɶ�����̼��������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����������γ�˳���칹�����
A. 1��1-������ϩ B. ��ϩ C. 1��2-������ϩ D. 1-��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
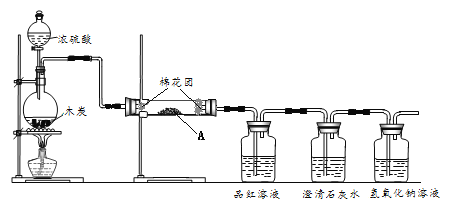
����Ŀ��X��Y��Z��W��MΪ����������Ԫ�أ�25��Cʱ��������������Ӧ��ˮ���Ũ�Ⱦ�Ϊ 0.01mol.L-1)��Һ��pH��ԭ�Ӱ뾶�Ĺ�ϵ��ͼ��ʾ�������й�˵������ȷ����
A. Y�����������ĵ���ʽΪ��![]()
B. �����̬�⻯������ȶ��ԣ�Z>W
C. X��M����Ԫ���γɵļ����Ӱ뾶��С˳��X<M
D. X���⻯����Z���⻯�ﷴӦ�����ɵĻ������мȺ����Ӽ��ֺ����ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ȼ����������һ�����ʣ���Щ���н�ǿ���������������ԡ�ijЩ�����������ת��������˵���������
A. ��Ҷȩ�ķ���ʽΪC10H16O
B. ��Ҷ������éȩ��Ϊͬ���칹��
C. �����������ʾ���ʹ���Ը��������Һ����ˮ��ɫ
D. ��é�����Է���ȡ����Ӧ�ӳɷ�Ӧ��������Ӧ�����Dz��ܷ�����ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У���Ӧ�����ɼ����������( )
A.Na��H2OB.Na2O��H2OC.Na2O2��CO2D.Na2O2��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������س���������ɱ����ˮ�ʾ������ȡ�ijС�������̿�(��Ҫ��MnO2,����������SiO2��Al2O3��Fe2O3������)ģ�ҵ�Ƹ�������������¡��Իش��������⡣
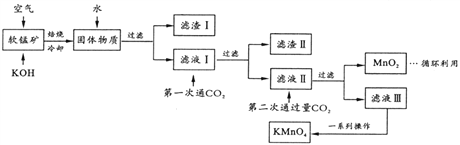
(1)��ƽ����ʱ��ѧ��Ӧ: ��MnO2+��_____+��O2![]() ��K2MnO4+��H2O����ҵ�����в��öԿ�����ѹ�ķ������MnO2�����ʣ�������ײ���۽�����ԭ��__________��
��K2MnO4+��H2O����ҵ�����в��öԿ�����ѹ�ķ������MnO2�����ʣ�������ײ���۽�����ԭ��__________��
(2)����II �ijɷ���_______(��ѧʽ);��һ��ͨCO2������ϡ��������ԭ����_________��
(3)�ڶ���ͨ�����CO2����MnO2�����ӷ���ʽΪ_________��
(4)����Һ������һϵ�в�����KMnO4��
����ͼ��֪,����Һ��õ�KMnO4�辭��_____��______��ϴ�ӵȲ�����

(5)��ҵ�ϰ���������������������MnO2a%�����̿�1�֣�������������KMnO4___�֡�
(6)���õ�ⷨ�ɵõ�������KMnO4���ö��Ե缫�����ҺII��
�ٵ���������ӦʽΪ____________��
���������������������,��������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����PtΪ�缫����⺬��0.10molM+��0.10molN3+(M+��N3+��Ϊ����������)����Һ�����������������ʻ�����������ʵ���(y)�뵼����ͨ�����ӵ����ʵ���(x)�Ĺ�ϵ����ͼ������������������ǿ���ж���ȷ���ǣ� ��
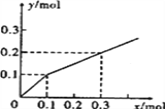
A. N3+>H+>M+
B. M+>N3+>H+
C. M+>H+>N3+
D. �������㣬��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ���У��ס��ҡ��������ձ����ηֱ�ʢ��100 g 5.00%��NaOH��Һ��������CuSO4��Һ��100 g 10.00%��K2SO4��Һ���缫��Ϊʯī�缫��
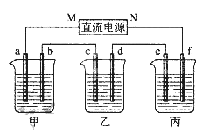
��ͨ��Դ������һ��ʱ���ñ���K2SO4Ũ��Ϊ10.47%������c�缫�������ӡ��ݴ˻ش����⣺
��1����Դ��N��Ϊ________����
��2���缫b�Ϸ����ĵ缫��ӦΪ:__________________�����ɵ������ڱ�״���µ����Ϊ__________L��������λ��Ч���֣�;
��3����Ҫʹ����Һ�ָ������ǰ��״̬����������Һ�м���________���ѧʽ��������Ϊ________g��������λ��Ч���֣���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com