
| A、原电池放电过程中,负极质量一定减轻,或正极的质量一定增加 |
| B、Fe、Cu组成原电池:Fe一定是负极 |
| C、为加快一定量的Zn与足量稀H2SO4反应的速率,且不影响生成H2总量,可加入少量CuSO4 溶液 |
| D、某海水电池总反应表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,则负极反应式:Ag-e-+Cl-=AgCl |


科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A、保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | ||
| B、保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol | ||
C、反应在t1min内的平均速率为v(H2)=
| ||
| D、温度升至800℃,上述反应平衡常数为0.64,则正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子晶体 | B、分子晶体 |
| C、原子晶体 | D、金属晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
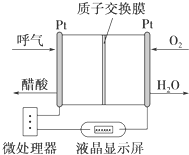 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )| A、电流由O2所在的铂电极经外电路流向另一电极 |
| B、O2所在的铂电极处发生还原反应 |
| C、该电池的负极反应式为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ |
| D、微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 根据如图所示装置回答:
根据如图所示装置回答:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的能量一定高于M |
| B、X和Y的总能量一定高于M和N的总能量 |
| C、Y的能量一定高于N |
| D、因为该反应为放热反应,故不必加热反应就可发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若A2+2D-═2A-+D2,则还原性:D->A- |
| B、若R2+和M+的电子层结构相同,则碱性:ROH>MOH |
| C、若X2、Y2都是气态单质,且酸性HX>HY,元素原子得电子能力X>Y |
| D、若M、N是同主族元素,且原子序数:M>N,则元素原子得电子能力:M>N |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2、SO2、NO2都能和碱溶液反应,它们都是酸性氧化物. |
| B、常温常压下,1 molCH4完全燃烧放出的热量为CH4的燃烧热. |
| C、在火法炼铜反应2CuFeS2+O2=Cu2S+2FeS+SO2中,1mol硫被氧化时转移6 mol电子 |
| D、0.l mol AlCl3完全水解转化为氢氧化铝胶体,生成0.lNA个胶粒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com