
【题目】下列物质中,在一定条件下能发生取代反应和加成反应,但不能使酸性高锰酸钾溶液褪色的是( )
A.苯B.甲烷C.乙烷D.乙烯
科目:高中化学 来源: 题型:
【题目】元素化合物知识是高中化学的基础。H、Na、Mg、Ca、Al、Cr、Cu、Br、Cl等是中学化学中常见的元素,请根据题意回答与这些元素有关的问题。
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为______;CuSO4粉末常用来检验一些有机物中的微量水分,若含有微量水分则会看到的现象是______。
(2)单质镁在空气中燃烧的主要产物是白色的_______(填化学式),还生成少量的______(填化学式)。金属镁还可以与卤素反应,生成的MgI2中 Mg2+与I-间的作用力______MgF2 中 Mg2+与 F-间的作用力(填“>”、“<”或“=”)。
(3)Ca元素与 H 元素组成的物质为_____________(填“共价”或“离子”)化合物,该物质可以与水反应,产生的气体可作为野外工作的应急燃料,该反应的化学方程式为______。
(4)硬脂酸钠(C17H35COONa)是肥皂的主要成分, 主要用于制造皂类洗涤剂、 化妆品的乳化剂等。鉴别硬脂酸钠(C17H35COONa)与硬脂酸钾(C17H35COOK)可采用的实验方法和现象分别是____________。
(5)已知元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH) 4- (绿色)、Cr2O72- (橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3 为难溶于水的灰蓝色固体。Cr3+与 Al3+的化学性质相似,在Cr2(SO4)3 溶液中逐滴加入NaOH 溶液直至过量,可观察到的现象是______。
(6)溴与氯能以共价键结合形成 BrCl。 BrCl 分子中,______显正电性。已知 BrCl 可以与水发生反应,且该反应为非氧化还原反应,则该反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NO等有害气体。
(1)汽车尾气中NO生成过程的能量变化示意图如下:
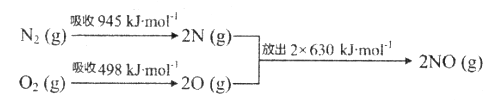
该条件下,1mol N2和1molO2完全反应生成NO,会_______________(填“吸收”或“放出”)________kJ能量。
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如下图所示:
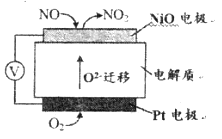
①NiO电极上发生的是_______________反应(填“氧化”或“还原”)。
②外电路中,电子的流动方向是从_______电极流向______电极(填“NiO”或“Pt”);Pt电极上的电极反应式为_______________。
(3)一种新型催化剂能使NO和CO发生反应:2NO+2CO ![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
实验 编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.20×10-3 | B | 124 |
Ⅲ | 350 | A | 5.80×10-3 | 82 |
①请把表中数据补充完整:A_______________;B_______________。
②能验证温度对化学反应速率影响规律的是实验_______________(填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如下图所示,其中表示实验Ⅱ的是曲线_________(填“甲”或“乙”)。
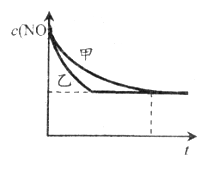
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是![]()
A. 容器内压强不随时间变化
B. v正(X) =v逆(Z)
C. 容器内X、Y、Z的浓度之比为l:2:2
D. 单位时间内消耗0.1molX的同时生成0.2molZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中A与B反应生成C,其反应速率分别用v(A),v(B),v(C)表示,已知v(A),v(B),v(C)之间有以下关系3v(A)=2v(B),3v(C)=2v(B),则此反应可表示为( )
A.2A+3B=2C
B.A+3B=2C
C.3A+B=2C
D.A+B=C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组选用以下装置进行实验设计和探究(图中a、b、c均为止水夹):
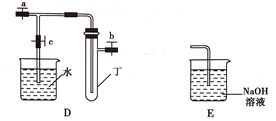
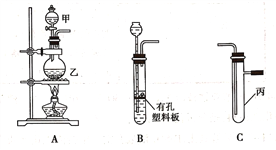
(1)在进行气体制备时,应先检验装置的气密性。将A装置中导管末端密封后,在分液漏斗甲内装一定量的蒸馏水,然后__________________________________________,则证明A装置的气密性良好。
(2)利用E装置能吸收的气体有__________________________________(任写两种即可)。
(3)用锌粒和稀硫酸制备H2时应选用装置________作为发生装置(填所选装置的字母序号),实验时先在稀硫酸中加入少量硫酸铜晶体可使反应速率加快,原因是___________________________。
(4)某同学将A、C、E装置连接后设计实验比较Cl-和S2-的还原性强弱。
①A中玻璃仪器乙的名称为______________________,A装置中发生反应的离子方程式为
_____________________________________________。
②C中说明Cl-和S2-的还原性强弱的实验现象是_______________________________________。
(5)另一同学将B、D、E装置连接后,在B装置中加入铜片和浓硝酸,制取NO2,然后进行NO2气体与水反应的实验,并观察相关现象:
①B装置中发生反应的离子方程式为________________________________________________。
②反应一段时间后D装置中的具支试管丁中收集满NO2气体,若进行NO2气体与水反应的实验,应____________________________________(填对a、b、c三个止水夹进行的操作),然后再适当加热丁。实验现象为____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废铅蓄电池的铅泥(PbO、Pb及PbSO4等)可制备精细无机化工产品“三盐”(3PbO·PbSO4·H2O),主要制备流程如下:

(1)步骤①PbSO4转化为难溶PbCO3的离子方程式为 ____________________________。
(2)滤液1和滤液3经脱色、蒸发、结晶可得到的副产品为____________(写化学式)。
(3)步骤③酸溶时,其中的铅与硝酸生成Pb(NO3)2及NO的离子方程式为____________________________;滤液2中溶质主要成分为________(写化学式)。
(4)步骤⑥合成三盐的化学方程式为 _______________________________________。
(5)步骤⑦洗涤操作时,检验沉淀是否洗涤干净的方法是 ___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的 ( )
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(molL﹣1) | V/mL | c/(molL﹣1) | V/mL | ||
A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修3——物质结构与性质】B、C、N、Si是几种常见的重要非金属元素,其形成的各种化合物在自然界中广泛存在。
(1)基态硅原子的电子排布式为________________________________。
B、C、N元素原子的第一电离能由大到小的顺序为______________________。
(2)BF3与一定量的水可形成如图所示晶体R。
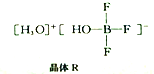
①晶体R中各种微粒间的作用力涉及___________(填字母代号)。
a.离子键 b.共价键 C.配位键 d.金属键 e.范德华力
②晶体R中阴离子的空间构型为___________________________。
(3)乙二胺(H2NCH2CH2NH3)与CuCl2溶液可形成配离子(结构如图所示),乙二胺分子中氮原子的杂化类型为_______。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的佛点高得多,其原因是_______。
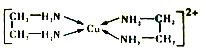
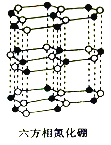
(4)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。它的晶体结构如图所示。六方相氮化硼是否含有π键?______(填“含”或“不含”),其质地软的原因是________________________________________,该物质能否导电?____________(填“能”或“不能”),其原因是______________________________。
(5)SiC是原子晶体,其晶胞结构类似金刚石,假设正方体的边长为acm,估算SiC晶体的密度为______ g·cm-3(用含NA、a的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com