
【题目】汽车尾气中含有CO、NO等有害气体。
(1)汽车尾气中NO生成过程的能量变化示意图如下:
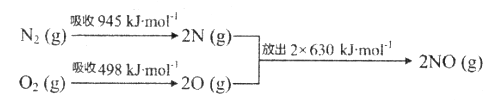
该条件下,1mol N2和1molO2完全反应生成NO,会_______________(填“吸收”或“放出”)________kJ能量。
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如下图所示:
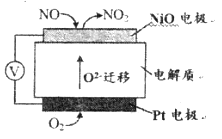
①NiO电极上发生的是_______________反应(填“氧化”或“还原”)。
②外电路中,电子的流动方向是从_______电极流向______电极(填“NiO”或“Pt”);Pt电极上的电极反应式为_______________。
(3)一种新型催化剂能使NO和CO发生反应:2NO+2CO ![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
实验 编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.20×10-3 | B | 124 |
Ⅲ | 350 | A | 5.80×10-3 | 82 |
①请把表中数据补充完整:A_______________;B_______________。
②能验证温度对化学反应速率影响规律的是实验_______________(填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如下图所示,其中表示实验Ⅱ的是曲线_________(填“甲”或“乙”)。
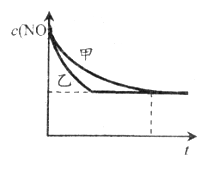
【答案】 吸收 183 氧化 NiO Pt O2+4e-=2O2- 1.20×10-3 5.80×10-3 实验Ⅰ和实验Ⅲ 乙
【解析】(1)根据图中信息可得热化学方程式N2(g)+O2(g)=2NO(g) ![]() H=(+945+498-2×630) kJ/mol=+183kJ/mol,故该条件下,1mol N2和1molO2完全反应生成NO,会吸收183kJ能量;(2)由题给装置图知,该装置为原电池,O2- 由Pt电极移向NiO电极,则Pt电极为原电池的正极,NiO为负极。①NiO为负极,电极上NO失电子和氧离子反应生成二氧化氮,发生氧化反应;②外电路中,电子的流动方向是从负极NiO电极流向正极Pt电极;Pt为正极,电极上的电极反应式为O2+4e-=2O2-;(3)①因Ⅰ、Ⅱ比表面积不同,则应控制温度相同,所有浓度应控制相同来验证催化剂比表面积对速率的影响;Ⅰ、Ⅲ比表面积相同,温度不同,则所有浓度应控制相同来验证反应温度对速率的影响,故答案为:A1.20×10-3;B 5.80×10-3; ②能验证温度对化学反应速率影响规律的是实验实验Ⅰ和实验Ⅲ;③因Ⅰ、Ⅱ温度相同,催化剂对平衡移动无影响,则平衡不移动,但Ⅱ的速率大,则Ⅱ先达到化学平衡,其中表示实验Ⅱ的是曲线乙。
H=(+945+498-2×630) kJ/mol=+183kJ/mol,故该条件下,1mol N2和1molO2完全反应生成NO,会吸收183kJ能量;(2)由题给装置图知,该装置为原电池,O2- 由Pt电极移向NiO电极,则Pt电极为原电池的正极,NiO为负极。①NiO为负极,电极上NO失电子和氧离子反应生成二氧化氮,发生氧化反应;②外电路中,电子的流动方向是从负极NiO电极流向正极Pt电极;Pt为正极,电极上的电极反应式为O2+4e-=2O2-;(3)①因Ⅰ、Ⅱ比表面积不同,则应控制温度相同,所有浓度应控制相同来验证催化剂比表面积对速率的影响;Ⅰ、Ⅲ比表面积相同,温度不同,则所有浓度应控制相同来验证反应温度对速率的影响,故答案为:A1.20×10-3;B 5.80×10-3; ②能验证温度对化学反应速率影响规律的是实验实验Ⅰ和实验Ⅲ;③因Ⅰ、Ⅱ温度相同,催化剂对平衡移动无影响,则平衡不移动,但Ⅱ的速率大,则Ⅱ先达到化学平衡,其中表示实验Ⅱ的是曲线乙。


科目:高中化学 来源: 题型:
【题目】某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果。
实验Ⅰ
物质 | 0 min | 1min | 1h | 5h |
FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
(NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(1)溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”)
(2)结合离子方程式解释FeSO4溶液中加入KSCN溶液后变红的原因____________。
(3)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行实验II,否定了该观点,补全该实验。
操作 | 现象 |
取_______,加_______,观察。 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
(4)乙同学提出实验Ⅰ中两溶液的稳定性差异是溶液酸性不同导致,进行实验III:分别配制0.80 mol·L-1 pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应:4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+。
4Fe(OH)3+8H+。
由实验III,乙同学可得出的结论是___________,原因是__________________。
(5)进一步研究在水溶液中Fe2+的氧化机理。测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如下图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率都逐渐增大的原因可能是_____________。
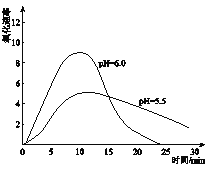
(6)综合以上实验,增强Fe2+稳定性的措施有_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,某些不饱和烃分子可以进行自身加成反应.例如: ![]() ,有机物甲的结构简式为
,有机物甲的结构简式为 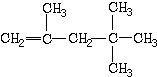 ,它是由不饱和烃乙的两个分子在一定条件下自身加成得到,在此反应中除生成甲外,还同时生成另一种产量更高的有机物丙,其最长碳链仍为5个碳原子,丙是甲的同分异构体.
,它是由不饱和烃乙的两个分子在一定条件下自身加成得到,在此反应中除生成甲外,还同时生成另一种产量更高的有机物丙,其最长碳链仍为5个碳原子,丙是甲的同分异构体.
(1)乙的结构简式是 .
(2)丙的结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下CH3COOH和NH3·H2O的电离平衡常数分别为Ka、Kb。若在常温下向0.1mol/L的醋酸溶液中逐滴加入相同浓度的氨水直至完全过量,则下列说法正确的是
A. 加入氨水的过程中,溶液的导电性一直不断增强
B. CH3COONH4在水溶液中的水解平衡常数Kh=Kw/(Ka+Kb)
C. 若Ka≈Kb,当加入等体积的氨水时,溶液基本呈中性
D. 该等式在滴加过程中始终成立c(CH3COO-)+c(CH3COOH)=c(NH4+)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牛通过吃草从草中获得化合物和元素,那么,牛和草体内的各种化学元素( )
A.种类差异很大,含量大体相同
B.种类和含量差异都很大
C.种类和含量都是大体相同的
D.种类大体相同,含量差异很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在细胞内含量极少,但对维持生命活动必不可少的元素有( )
A.Fe Mn Zn Mg B.Zn Cu Mg Ca
C.Zn Cu B Mn D.Mg Mn Cu Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。下列说法错误的是

A. ②的作用是安全瓶
B. ③中试剂更换为Ba(NO3)2后,无明显现象发生
C. ④中的现象说明SO2具有氧化性
D. ⑤用于检验SO2的漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碱金属元素的性质判断正确的是( )
A.K与H2O反应最剧烈
B.Rb比Na活泼,故Rb可以从NaCl溶液中置换出Na
C.碱金属的阳离子没有还原性,所以有强氧化性
D.从Li到Cs都易失去最外层1个电子,且失电子能力逐渐增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com