
【题目】黄铜矿不仅可用于火法炼铜,也可用于湿法炼铜,湿法可同时生产铜、磁性氧化铁和用于橡胶工业的一种固体物质A,流程如下:
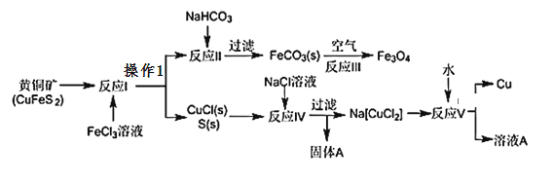
(1)黄铜矿中Cu的化合价是______,反应I中________molFeC13 可氧化0.1mol CuFeS2。
(2)实验室在进行操作1时,除使用烧杯外,还需使用的玻璃仪器有___________。
(3)工业生产中的过滤操作多采用倾析法(倾析法:先把清液倾入漏斗中,让沉淀尽可能地留在烧杯内)分离出固体物质,下列适合用倾析法的有____________。
a.沉淀的颗粒较大 b.沉淀呈胶状 c.沉淀容易沉降 d.沉淀呈絮状。
(4)固体物质A的成分________(写名称),本流程中可实现循环使用的物质除水外还有_______________
(5)反应Ⅲ是在设备底部鼓入空气,高温氧化锻烧法来制备磁性氧化铁,写出对应的化学方程式_________________________________________。
【答案】+20.4漏斗、玻璃棒ac硫氯化钠(NaCl)6FeCO3+O2![]() 2Fe3O4+6CO2
2Fe3O4+6CO2
【解析】
(1)黄铜矿CuFeS2中铁元素显+2价,S元素显-2价,故铜元素显+2;CuFeS2中硫元素化合价由-2价升高到0价,共升高4价,硫元素被氧化,氧化0.1mol CuFeS2转移0.4mol电子;三价铁还原为二价铁化合价降1,若得电子0.4mol,则应消耗FeC130.4mol; (2)实验室在进行操作1后得到固体和溶液则为过滤,除使用烧杯外,还需使用的玻璃仪器有漏斗、玻璃棒;(2)沉淀的颗粒较大,静止后容易沉降至容器底部,常用倾析法分离,沉淀呈胶状或絮状,静止后不容易沉降,不能采取倾析法分离;答案选项ac;(4)滤渣为S、CuCl,与NaCl溶液发生反应Ⅳ:CuCl+NaCl=Na[CuCl2],S不溶,过滤得到Na[CuCl2]溶液,固体为S;反应Ⅳ使用氯化钠溶液,反应Ⅴ生成的溶液A含有CuCl2、NaCl,氯化钠可循环使用;(5)高温氧化锻烧法来制备磁性氧化铁,化学方程式为:6FeCO3+O2![]() 2Fe3O4+6CO2。
2Fe3O4+6CO2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列反应中生成H2的速率最快的是( )
金属 | 酸溶液 | 温度 | |
A | Mg | 0.5 mol·L-1 H2SO4 | 20℃ |
B | Mg | 1 mol·L-1 H2SO4 | 30℃ |
C | Zn | 2 mol·L-1 HCl | 20℃ |
D | Fe | 1 mol·L-1 HCl | 20℃ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一较浓的无色溶液,向其中加入少量的BaCl2溶液和稀HNO3 , 振荡,有白色沉淀生成,则原溶液中存在的离子( )
A.只有SO42﹣
B.只有Ag+
C.有SO42﹣和Ag+
D.有SO42﹣或Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+nB(g)![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是
pC(g)的速率和平衡的影响图像如下,下列判断正确的是
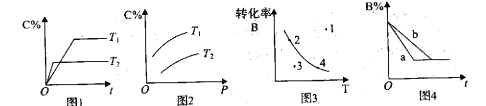
A. 由图1可知,T1<T2,该反应正反应为吸热反应
B. 由图2可知,该反应m+n<p
C. 图3中,点3的反应速率V正>V逆
D. 图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示有关的一种反应物或生成物(无关物质已略去),其中A、C为无色气体,请填写下列空白。

(1)B是____________,W是__________。(填化学式)
(2)用单线桥法标出反应①电子转移的方向和数目:_________________。
(3)写出G与Cu在加热条件下能反应生成E和F的物质的量之比为1∶1的化学方程式:________________________________________________________________________。
(4)若W是酸式盐,_________g W加热分解的产物通过足量的Na2O2,固体Na2O2增重3g,则转移的电子总数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出的有关表述中不准确的是
序号 | A | B | C | D |
物质类型 | 离子化合物 | 共价键直接构成的物质 | 共价分子 | 稀有气体 |
代表物质 | NaCl | 金刚石 | 干冰 | Ne |
组成晶体的结构微粒 | Na+、Cl- | C | CO2 | Ne |
结构微粒间相互作用 | 离子键 | 共价键 | 分子间作用力 | 共价键 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)5 mol的CO2与8 mol的SO2的分子数之比是________;原子数之比是________;质量比是________。
(2)KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为:________KClO3+________HCl(浓)===________KCl+________ClO2↑+________Cl2↑+________H2O
①配平以上化学方程式(化学计量数填入划线上)。
②ClO2是反应的________(填“氧化”或“还原”)产物。浓盐酸在反应中显示出来的性质是(填写号码)________。
a.还原性 b.氧化性 c.酸性 d.碱性
③反应产生0.1 mol Cl2,则转移的电子的物质的量为________ mol。
④ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位质量得到电子数表示)是Cl2的________倍(保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其氧化物是日常生活生产中应用广泛的材料,请回答下列问题:
(1)基态铁原子的价电子排布式为_________。
(2)Fe3+、Co3+与N3+、CN-等可形成络合离子。
①C、N、O中第一电离能最大的为________,其原因是_____________________。
②K3[Fe(CN)6]可用于检验Fe2+,1mol K3[Fe(CN)6]中含有σ键的数目为________________。
(3)铁的另一种配合物Fe(CO)x的中心原子价电子数与配体提供的电子数之和为18,则x=_____。已
知该配合物的熔点为-20.5 ℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)x晶体属于_____________(填晶体类型)。
(4)金属铁晶体中原子采用_________堆积,铁晶体的空间利用率为______(用含π的式子表示)。
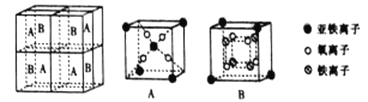
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B 方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为_______________(填最简整数比);已知该晶体的密度为d g·cm-3,阿伏加德罗常数的值为NA,则晶胞参数a为_______________nm(用含d和NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com