
【题目】下列物质中,含有离子键的是( )
A.HClB.H2O2C.K2OD.H2SO4
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某课外实验小组设计的下列实验不合理的是( )
A. 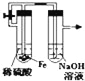 制备并观察氢氧化亚铁
制备并观察氢氧化亚铁
B. 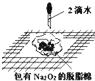 证明过氧化钠与水反应放热
证明过氧化钠与水反应放热
C. 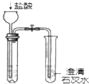 鉴别碳酸钠与亚硫酸钠
鉴别碳酸钠与亚硫酸钠
D. 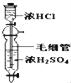 制备少量干燥的氯化氢气体
制备少量干燥的氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
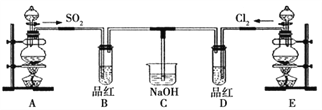
(1)实验室用装置A制备SO2。从物质类别看,SO2属于________(填“酸性”、“两性”或“碱性”)氧化物;
(2)实验室用装置E制备Cl2,写出该反应的离子方程式:___________________________。当有0.2 mol电子转移时,产生氯气的体积(标准状况)是________,氧化剂与还原剂的物质的量之比是________。
(3)反应开始一段时间后,观察到B、D两个试管中的品红溶液均褪色。停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:________________,D:________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1︰1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)____________________________。
(5)有人预测SO2能使酸性高锰酸钾溶液褪色,你认为该预测是否合理?________(填“合理”或“不合理”),理由是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是
A. 乙烯与溴的四氯化碳溶液反应 B. 苯在一定条件下与氢气反应
C. 甲烷与氯气在光照条件下反应 D. 乙醇在一定条件下生成乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是氯碱工业的主要产品之一,常作强氧化剂,可与有机物和无机物进行反应生成多种氯化物。某兴趣小组在实验室中对以下反应进行了探究。回答下列问题:
Ⅰ、三氯化硼(BCl3)的制备,已知:①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃; ②2B+6HCl ![]() 2BCl3↑+3H2↑。
2BCl3↑+3H2↑。

(1)按气流方向连接各装置的接口,顺序为a→( )→( )→( )→( )→( )→( )→f→g→h。_________
(2)装置D的作用是_____________;实验中若不用装置C,可能产生的危险是____________。
(3)BCl3遇水发生水解观察到大量的白雾,生成两种酸,其反应的化学方程式为:___________。
Ⅱ、SO2与漂粉精溶液的反应
操作 | 现象 |
取4g 漂粉精固体,加入100mL 水,测漂粉精溶液的pH | pH 试纸先变蓝(约为12),后褪色 |
| 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀,黄绿色褪去 |
(4)pH试纸颜色的变化说明漂粉精溶液具有的性质是_____________________________。
(5)现象2中溶液变为黄绿色的原因是:随溶液酸性的增强,漂粉精的有效成分和Cl- 发生反应。该反应的离子方程式为________________________。
(6)用离子方程式解释现象3中黄绿色褪去的原因_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某同学用下图所示的装置做了有关氨气的性质实验。
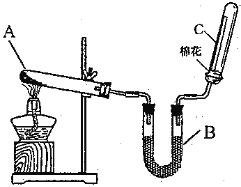
(1)写出A处氯化铵固体与熟石灰共热反应的化学方程式:_____________________________。
(2)B中盛放的是碱石灰,其作用是_____________________________。
(3)氨气极易溶于水,在氨水中滴加酚酞,现象是_________________________________。
(4)检验氨气的方法是___________________________________________________________。
Ⅱ.乙烯是一种重要的有机化工原料。在一定条件下乙烯可发生如下转化:
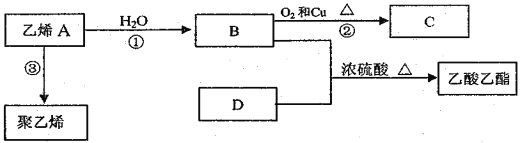
(1)乙烯的结构简式是_______________,D的分子式是_______________。
(2)B中含氧官能团的名称是_____________,③的反应类型是______________。
(3)写出反应②的化学方程式: ________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅﹣硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图II所示电池放电过程中,硫酸浓度不断增大
C.图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图IV所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com