
【题目】某溶液中存在大量的H+、Cu2+和Cl-,该溶液中还可能大量共存的离子是( )
A. OH-B. Ag+C. HCO3-D. Fe2+
科目:高中化学 来源: 题型:
【题目】由H、Na、Mg、S、O、Cl六种元素组成的物质,按要求,每小题各写出一个化学方程式
(1)是化合反应又是氧化还原反应的 .
(2)是分解反应又是氧化还原反应的 .
(3)是氧化还原反应又是置换反应的 .
(4)写出酸性氧化物与可溶性碱反应的化学方程式 .
(5)写出碱性氧化物与水反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国“复兴号”高速列车的运行速度达到350 km·h-1。高速列车制造要使用轻质金属材料。下列可以作为轻质金属材料的是( )
A. 铝合金B. 铁合金
C. 碳素纤维D. 硅纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1861年,比利时人索尔维以食盐、石灰石和氨为原料,制得了碳酸钠.这种制碱方法称为氨碱法,其主要步骤是:
①在含氨的饱和氯化钠溶液中通入CO2制得NaHCO3
②再将NaHCO3焙烧制得纯碱,CO2循环使用
③析出小苏打的母液中加入生石灰,NH3循环使用
我国著名化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
(1)上述生产纯碱的方法称 , 副产品的一种用途为 .
(2)沉淀池中发生的化学反应方程式是 .
(3)写出上述流程中X物质的分子式 .
(4)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 .
(5)设计实验检验产品碳酸钠中是否含有氯化钠
(6)侯德榜制碱的方法与氨碱法相比,其优点是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z,W均为短周期元素,它们在元素周期表中相对位置如图所示,已知W原子的最外层电子数比内层电子数少3 个,下列说法正确的是( ) 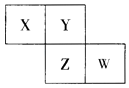
A.氧化物对应水化物酸性W比Z强
B.Y单质与Z的氢化物水溶液反应,有沉淀生成
C.X单质氧化性强于Y单质
D.简单离子的半径:Z<W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴(Co)、镍(Ni)是同族元素,都是较活泼的金属,它们的化合物在工业上有重要的应用.
(1)草酸钴(CoCO)是一种难溶于水的浅粉红色粉末,通常用硫酸钴溶液和草酸铵溶液反应制得,写出该反应的离子方程式:
(2)现将含0.5mol FeCl3的溶液和含0.5mol KSCN的溶液混合,混合后溶液体积为1L,已知溶液存在平衡:Fe3++SCN﹣Fe(SCN)2+(忽略其它过程).平衡浓度c[Fe(SCN)2+]与温度T的关系如图1所示:则该反应△H0(填“>”或“<”),温度为T1时,反应在5秒钟时达到平衡,平衡时c[Fe(SCN)2+]=0.45mol/L,求达到平衡时的平均反应速率
v(SCN﹣)=molL﹣1S﹣1 , 该温度下的Fe3+的平衡转化率为 , 该温度下反应的平衡常数为 . 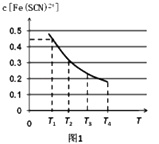
(3)已知某溶液中,Co2+、Ni2+的浓度分别为0.60mol/L和1.2mol/L,取一定量的该溶液,向其中滴加NaOH溶液,当Co(OH)2开始沉淀时,溶液中 ![]() 的值等于 . (取两位有效数字)
的值等于 . (取两位有效数字)
(已知Ksp[Co(OH)2]=6.0×10﹣15 , Ksp[Ni(OH)2]=2.0×10﹣15)
(4)工业上还可用通过电解浓NaOH溶液制备Na2FeO4 , 其工作原理如图2所示,则阳极的电极反应式为 . 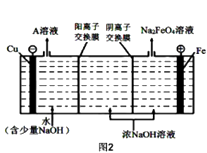
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com