
【题目】1861年,比利时人索尔维以食盐、石灰石和氨为原料,制得了碳酸钠.这种制碱方法称为氨碱法,其主要步骤是:
①在含氨的饱和氯化钠溶液中通入CO2制得NaHCO3
②再将NaHCO3焙烧制得纯碱,CO2循环使用
③析出小苏打的母液中加入生石灰,NH3循环使用
我国著名化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
(1)上述生产纯碱的方法称 , 副产品的一种用途为 .
(2)沉淀池中发生的化学反应方程式是 .
(3)写出上述流程中X物质的分子式 .
(4)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 .
(5)设计实验检验产品碳酸钠中是否含有氯化钠
(6)侯德榜制碱的方法与氨碱法相比,其优点是
【答案】
(1)联合制碱法;作化肥
(2)NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓
(3)CO2
(4)增大铵根离子浓度,使氯化铵更多析出
(5)检验产品碳酸钠中是否含有氯化钠即检验是否含氯离子,可以用硝酸酸化的硝酸银,观察到若产生白色沉淀则说明有氯化钠存在,
故答案为:用硝酸酸化的硝酸银,观察产生白色沉淀
(6)把合成氨和纯碱两种产品联合起来,降低了成本
【解析】解:将二氧化碳和氨气、食盐水加入沉淀池中,发生的反应为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,得到的沉淀在煅烧炉中发生反应2NaHCO3 ![]() Na2CO3+H2O+CO2 , 从而得到Na2CO3 , 煅烧过程中得到的X为CO2要循环利用,母液中含有的铵根离子和碱反应得到的氨气也能循环利用,(1)上述生产纯碱的方法称联合制碱法,副产品是氯化铵,铵盐可以作化肥,所以氯化铵能作化肥,所以答案是:联合制碱法;作化肥;(2)沉淀池中氯化钠、二氧化碳、氨气和水发生复分解反应生成碳酸氢钠和氯化铵,反应方程式为,
Na2CO3+H2O+CO2 , 从而得到Na2CO3 , 煅烧过程中得到的X为CO2要循环利用,母液中含有的铵根离子和碱反应得到的氨气也能循环利用,(1)上述生产纯碱的方法称联合制碱法,副产品是氯化铵,铵盐可以作化肥,所以氯化铵能作化肥,所以答案是:联合制碱法;作化肥;(2)沉淀池中氯化钠、二氧化碳、氨气和水发生复分解反应生成碳酸氢钠和氯化铵,反应方程式为,
NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,所以答案是:NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;(3)煅烧碳酸氢钠生成碳酸钠、二氧化碳和水,且二氧化碳能循环利用,X为CO2 , 所以答案是:CO2;(4)母液中溶质为氯化铵,向母液中通氨气加入细小食盐颗粒,冷却析出副产品,通入的氨气和水反应生成一水合氨,一水合氨电离出铵根离子,铵根离子浓度增大有利于析出氯化铵,
所以答案是:增大铵根离子浓度,使氯化铵更多析出;(5)检验产品碳酸钠中是否含有氯化钠即检验是否含氯离子,可以用硝酸酸化的硝酸银,观察到若产生白色沉淀则说明有氯化钠存在,
所以答案是:用硝酸酸化的硝酸银,观察产生白色沉淀;(6)氨碱法:以食盐(氯化钠)、石灰石(经煅烧生成生石灰和二氧化碳)、氨气为原料来制取纯碱,联合制碱法:以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱,氨碱法循环物质:氨气、二氧化碳,联合制碱法循环物质:氯化钠,二氧化碳,最大的优点是把合成氨和纯碱两种产品联合起来,降低了成本,
所以答案是:把合成氨和纯碱两种产品联合起来,降低了成本.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】对溴苯乙烯与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点.完成下列填空:
(1)写出该共聚物的结构简式 .
(2)丙烯催化二聚得到2,3﹣二甲基﹣1﹣丁烯,B与2,3﹣二甲基﹣1﹣丁烯互为同分异构体,且所有碳原子处于同一平面.写出B的结构简式 .
设计一条由2,3﹣二甲基﹣1﹣丁烯制备B的合成路线 .
(合成路线常用的表示方式为:A ![]() B…
B… ![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构为:原花青素具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病.有关原花青素的下列说法不正确的是( ) 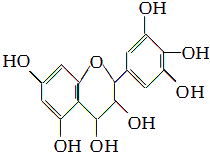
A.该物质既可看作醇类,也可看作酚类
B.1 mol该物质可与4 mol Br2反应
C.1 mol该物质可与7 mol NaOH反应
D.1 mol该物质可与7 mol Na反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X元素原子最外层有7个电子。Y元素的原子和X元素的原子次外层都有8个电子。在X与Y形成的离子化合物中,阴、阳离子的电子层结构相同。则X与Y形成的化合物的可能是化学式是 ( )
A. NaFB. MgCl2C. CaCl2D. KBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X、Y、Z三种常见非金属元素,A、B、C三种常见金属元素,已知有如下情况: ①X、Y、Z的单质在常温下均为气体.
②X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色.
③XZ极易溶于水,XZ的水溶液可使石蕊试液变红.
④2mol X的单质可与1mol Y的单质化合生成2mol X2Y,X2Y常温下为液体.
⑤Z的单质溶于X2Y中所得溶液具有漂白性
⑥A的单质可以在Z的单质中燃烧,生成棕黄色固体,该固体溶于水呈棕黄色溶液.
⑦B与Z形成的化合物BZ2溶于水加入NaOH溶液有蓝色沉淀生成.
⑧C的单质与Y单质反应可能得到两种产物,其中一种为淡黄色.
请完成下列问题:
(1)写出下列物质化学式:XZ , BZ2 .
(2)Z的单质溶于X2Y中所得溶液中起漂白作用的物质是(化学式).
(3)A的单质与Z的单质反应的化学方程式 .
(4)C的单质与Y单质反应生成淡黄色物质的化学方程式 .
(5)Z单质与NaOH溶液反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由铝粉与氧化铁组成的铝热剂,常用于焊接铁轨,试写出该反应的化学方程式:;在足量盐酸、氢氧化钠溶液中,分别加入ag该铝热剂充分反应,二者产生气体的体积比为(同温同压下).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然准晶颗粒由Al、Cu、Fe三种元素组成.回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过方法区分晶体、准晶体和非晶体.
(2)基态铁原子有_个未成对电子,三价铁离子的电子排布式为 . 三价铁离子比二价铁离子的稳定性更好,原因是 .
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为;乙酸的沸点明显高于乙醛,其主要原因是 .
(4)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2﹣ , 在形成配位键时,弧对电子由元素提供.
(5)氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有个铜原子.
(6)铝单质为面心立方晶体,其晶胞边长a=0.405nm,晶胞中铝原子的配位数为 . 列式表示铝单质的密度gcm﹣3(不必计算出结果).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于1mol·L-1的Na2SO4溶液说法正确的是( )
A. 溶液中含有1molNa2SO4 B. 1mol Na2SO4溶于1L水中制得
C. 1L溶液中含有1 mol Na2SO4 D. Na+的浓度是1mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com