
| A. | CO用于高炉炼铁 | |
| B. | 用稀盐酸除去热水瓶胆壁上的水垢(主要成分是CaCO3) | |
| C. | 用盐酸除铁锈(铁锈主要成分是Fe2O3) | |
| D. | 用小苏打(NaHCO3)治疗胃酸过多 |
分析 在发生的化学反应中,若存在元素的化合价升降,则利用氧化还原反应原理,结合对应物质的性质解答该题.
解答 解:A.CO用于高炉炼铁反应生成铁和二氧化碳,C、Fe化合价发生变化,则利用氧化还原反应原理,故A正确;
B.用醋除去热水瓶胆壁上的水垢,发生醋酸与碳酸钙的反应,不属于氧化还原反应,故B错误;
C.用盐酸除铁锈生成氯化铁和水,没有化合价变化,不属于氧化还原反应,故C错误;
D.用小苏打治疗胃酸过多,发生碳酸氢钠与盐酸的反应,不属于氧化还原反应,故D错误.
故选A.
点评 本题考查氧化还原反应,为高频考点,侧重于化学与生活的考查,明确发生的化学反应是解答本题的关键,并注意常见元素的化合价变化,题目较简单.


科目:高中化学 来源: 题型:填空题
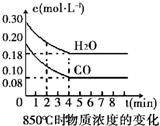 在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.CO和H2O浓度变化如右图,t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
在850℃时发生如下反应:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0.CO和H2O浓度变化如右图,t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、SiO32-、Cl-、NO3- | B. | H+、NH4+、Al3+、SO42- | ||
| C. | Na+、S2-、OH-、SO42- | D. | Na+、C6H5O-、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 强电解质 | 非电解质 | |
| A | NO2 | CuO | HF | KOH | H2SO4 | SO2 |
| B | CO2 | Na2O2 | HCl | Cu(OH)2 | HClO4 | CH4 |
| C | SiO2 | MgO | HClO | NH3•H2O | NaHCO3 | C2H5OH |
| D | Mn2O7 | K2O | HBr | Na2CO3 | Ba(OH)2 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 食盐加碘:着色剂 | B. | 火腿中的NaNO3:防腐剂 | ||
| C. | 炒菜放味精:调味剂 | D. | 用小苏打发面蒸馒头:膨松剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com