
室温下,下列溶液中粒子浓度大小关系正确的是
| A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) |
| B.Na2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) |
| C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) |
| D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) |
科目:高中化学 来源: 题型:单选题
室温下,对于0.10 mol·L—1的氨水,下列判断正确的是
| A.与AlCl3溶液发生反应的离子方程式为Al3++3OH—=Al(OH)3↓ |
| B.加水稀释后,溶液中c(NH4+)·c(OH—)变大 |
| C.用HNO3溶液完全中和后,溶液不显中性 |
| D.其溶液的pH=13 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| B.已知AgCl的Ksp=1.8×10-10、Ag2CrO4的Ksp=1.2×10-12,所以相同温度下AgCl的溶解度大于Ag2CrO4 |
| C.常温下,将pH =8的醋酸钠溶液稀释,溶液中所有离子浓度都减小 |
| D.反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)在室温下可自发进行,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中正确的是
| A.0. 1mol/L (NH4)2SO4溶液中:c(SO42—)<c(NH4+) |
| B.相同温度下,0.6 mol/L 氨水溶液与0.3 mol/L 氨水溶液中c(OH—)之比是2:1 |
| C.向0.1 mol/L NaNO3溶液中滴加稀HNO3使溶液中pH=5,则混合溶液中c(Na+)<c(NO3—) |
| D.常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)<c(CH3COO—) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)  Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O  HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4
HClO  H+ + ClO- Ka=?
H+ + ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是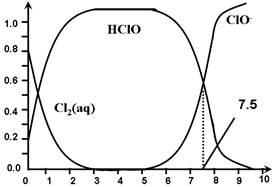
A.Cl2(g)+ H2O  2H+ + ClO- + Cl- K=10-10.9 2H+ + ClO- + Cl- K=10-10.9 |
| B.在氯处理水体系中,c(HClO) + c(ClO-) =c(H+)-c(OH-) |
| C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差 |
| D.氯处理饮用水时,在夏季的杀菌效果比在冬季好 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
| A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl-)>cCH3COO-)>c(OH-) |
| B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-) |
C.0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合: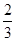 c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸): |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.常温下,PH=9的碳酸钠溶液中由水电离出的c(OH-)=1×10-9mol·L-1 |
| B.温度相同时,在弱酸溶液和强碱稀溶液中,水的离子积常数Kw相同 |
| C.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| D.中和等体积pH相同的H2SO4和HCl溶液,消耗NaOH的物质的量为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2mol·L-1HF溶液中加入1 L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确的是( )
| A.25℃时,0.1 mol·L-1HF溶液中pH=1 | B.Ksp(CaF2)随温度和浓度的变化而变化 |
| C.该体系中有CaF2沉淀产生 | D.加入CaCl2溶液后体系中的c(H+)浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25℃,pH=3的醋酸溶液(I)和pH=ll的氢氧化钠溶液(II),下列说法正确的是( )
| A.I和II中H2O的电离程度不相等 |
| B.将I稀释l0倍,溶液中c(CH3COOH)、c(OH﹣)均减小 |
| C.I和II溶液混合,若c(OH﹣)>c(H+),则氢氧化钠一定过量 |
| D.I和II等体积混合后,溶液中离子浓度大小为c(CH3COO﹣)+ c(CH3COOH>c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com