
| A. | ①③ | B. | ①② | C. | ②③ | D. | 全部正确 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
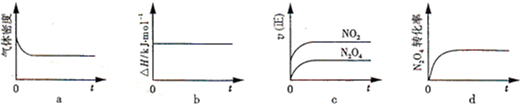
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=3的盐酸和PH=11的氨水 | B. | PH=3的硝酸和PH=11的Ba(OH)2溶液 | ||
| C. | PH=3的硫酸和PH=11的氨水 | D. | PH=3的醋酸和PH=11的Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)发射卫星可用气态肼为燃料,肼的分子式为N2H4,肼的电子式为
(1)发射卫星可用气态肼为燃料,肼的分子式为N2H4,肼的电子式为 .
. .一定量的该气体反应过程的能量变化如图所示,该反应为放热 (填“放热”或“吸热”)反应.25℃,101kPa时,1mol该气体在氧气中燃烧放出热量为akJ,该气体燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-aKJ/mol.
.一定量的该气体反应过程的能量变化如图所示,该反应为放热 (填“放热”或“吸热”)反应.25℃,101kPa时,1mol该气体在氧气中燃烧放出热量为akJ,该气体燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-aKJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
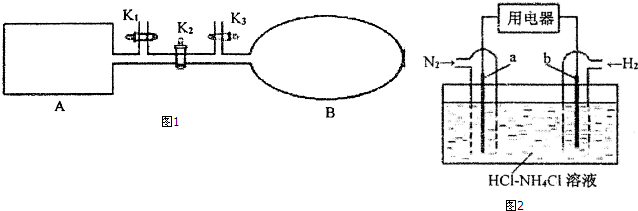
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si投入NaOH溶液中Si+2OH-═SiO${\;}_{3}^{2-}$+H2 | |
| B. | 把Al中投入到少量氢氧化钠溶液Al3++3OH-═Al(OH)3↓ | |
| C. | 向明矾水溶液中滴加氢氧化钡溶液,恰好使“SO42-”完全沉淀:Al3++2SO42-+2Ba2++2OH-═2BaSO4↓+Al(OH)3 | |
| D. | Na[Al(OH)4]溶液中加入过量的CO2:[Al(OH)4]-+CO2═HCO${\;}_{3}^{-}$+Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com