
分析 A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,可知B一定为Al,A为Na,E的最外层电子为11-1-3=7,则E为Cl元素;C元素的最外层电子数比次外层电子数少4,可知最外层电子为4,则C为Si元素;D元素可以形成DO2和DO3两种常见的氧化物,即D的最高价为+6加,D为S元素,结合元素化合物知识来解答.
解答 解:A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,可知B一定为Al,A为Na,E的最外层电子为11-1-3=7,则E为Cl元素;C元素的最外层电子数比次外层电子数少4,可知最外层电子为4,则C为Si元素;D元素可以形成DO2和DO3两种常见的氧化物,即D的最高价为+6加,D为S元素,
(1)由上述分析可知,B为Al,C为Si,故答案为:Al;Si;
(2)A、B两元素最高价氧化物的水化物分别为:Na0H、Al(OH)3,因氢氧化铝具有两性,故反应的方程式为Na0H+Al(OH)3═NaAl02+2H2O,
故答案为:Na0H+Al(OH)3═NaAl02+2H2O;
(3)C、D的最高价氧化物的水化物分别为:H2SiO3、H2SO4,依据为SiO32-+2H+=H2SiO3↓,为强酸制取弱酸的反应,故答案为:SiO32-+2H+=H2SiO3↓.
点评 本题考查位置、结构及性质的应用,为高频考点,把握元素在周期表的位置、元素化合物知识为解答的关键,注意电子排布的应用及氢氧化铝的两性,侧重分析与推断能力的考查,题目难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的化合物既能与盐酸反应也能与氢氧化钠反应 | |
| B. | X的原子半径大于Z的原子半径 | |
| C. | X与Z形成的化合物的水溶液中逐滴滴加氨水至过量,先产生白色沉淀后沉淀溶解 | |
| D. | Z的最高价氧化物对应的水化物为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
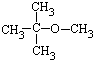 .
.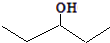 ,乙所含官能团的名称为羟基.
,乙所含官能团的名称为羟基. .
.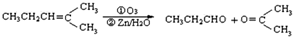
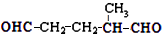 ,则烃A的结构可表示为
,则烃A的结构可表示为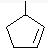 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①② | C. | ②③ | D. | 全部正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com