
(10分)溴乙烷是一种重要的有机化工原料,其沸点为38.4℃。
制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式
是
实际通常是用溴化钠与一定浓度的硫酸和乙醇反应。某课外小组欲
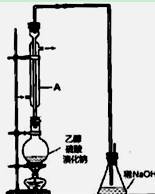
在实验室制备溴乙烷,其装置如右图,实验操作步骤如下:
① 检查装置的气密性;
② 在圆底烧瓶中加入95%乙醇、80%硫酸,然后加入研细的溴化钠
粉末和几粒碎瓷片;
③小心加热,使其充分反应。
请回答下列问题。
(1)装置A的作用是 。
(2)反应时若温度过高,则有SO2生成,同时观察到还有一种红棕色气体产生,该气体的电子式是 。
(3)反应结束后,得到的粗产品呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中
的 (填字母)。
a.稀氢氧化钠溶液 b.乙醇 c.四氯化碳
该实验操作中所需的主要玻璃仪器是 (填仪器名称)。
(4)要进一步制得纯净的溴乙烷,可继续用蒸馏水洗涤,分液后,再向有机物中加入无水CaCl2,然后进行的实验操作是 (填字母)。
a.分液 b.蒸馏 c.萃取
(5)为了检验溴乙烷中含有溴元素,不能直接向溴乙烷中滴加硝酸银溶液来检验,其原因是 。
通常采用的方法是取少量溴乙烷,然后 (按实验的操作顺序选填下列序号)。
A.加热 B.加入AgNO3溶液 C.加入稀HNO3酸化 D.加入NaOH溶液
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
 溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:| 硫酸 |
| 物质 数据 |
乙醇 | 溴乙烷 | 1,2-二溴乙烷 | 乙醚 | 浓硫酸 |
| 密度/g?cm-3 | 0.79 | 1.46 | 2.2 | 0.71 | 1.84 |
| 熔点(℃) | -130 | -119 | 9 | -116 | 10 |
| 沸点(℃) | 78.5 | 38.4 | 132 | 34.6 | 338 |
| 在水中的溶解度(g/100g水) | 互溶 | 0.914 | 1 | 7.5 | 互溶 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年吉林省延边州高三上学期质量检测理综化学试卷(解析版) 题型:实验题
溴乙烷是一种重要的有机化工原料,制备溴乙烷的原料有95%乙醇、80%硫酸(用蒸馏水稀释浓硫酸)、研细的溴化钠粉末和几粒碎瓷片,该反应的原理如下:
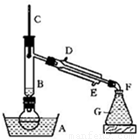
NaBr + H2SO4 → NaHSO4 + HBr
CH3CH2OH + HBr CH3CH2Br
+ H2O
CH3CH2Br
+ H2O
某课外小组欲在实验室制备溴乙烷的装置如右图。数据如下表。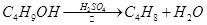
|
物质 数据 |
乙醇 |
溴乙烷 |
1,2-二溴乙烷 |
乙醚 |
浓硫酸 |
|
密度/g·cm-3 |
0.79 |
1.46 |
2.2 |
0.71 |
1.84 |
|
熔点(℃) |
-130 |
-119 |
9 |
-116 |
10 |
|
沸点(℃) |
78.5 |
38.4 |
132 |
34.6 |
338 |
|
在水中的溶解度(g/100g水) |
互溶 |
0.914 |
1 |
7.5 |
互溶 |
请回答下列问题。
(1)加入药品之前须做的操作是:_________________,实验进行的途中若发现未加入碎瓷片,其处理的方法是__________________。
(2)装置B的作用是除了使溴乙烷馏出,还有一个目的是_____________。温度计的温度应控制在_____________之间。
(3)反应时有可能生成SO2和一种红棕色气体,可选择氢氧化钠溶液除去该气体,有关的离子方程式是___________,______________,此操作可在___________(填写玻璃仪器名称)中进行,同时进行分离。
(4)实验中采用80%硫酸,而不能用98%浓硫酸,一方面是为了减少副反应,另一方面是为了_______________________。
(5)粗产品中含有的主要有机液体杂质是_____________,为进一步制得纯净的溴乙烷,对粗产品进行水洗涤、分液,再加入无水CaCl2,进行______________操作。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)反应原理:C2H5OH+NaBr+H2SO4![]() NaHSO4+C2H5Br+H2O
NaHSO4+C2H5Br+H2O
(2)主要装置见下图
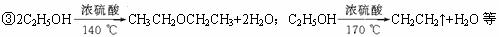
(3)操作步骤
①在100 mL圆底烧瓶中加入10 mL 95%乙醇、28 mL 78%硫酸,然后加入研细的13 g溴化钠。②加入几粒碎瓷片,小心摇动烧瓶使其均匀。将烧瓶与直形冷凝管相连,冷凝管下端连接接受器。③小心加热,使其充分反应,再进行蒸馏,直到无溴乙烷流出为止。④再将锥形瓶中液体冷却后倒入亚硫酸钠溶液中洗涤分液。
试回答下列问题:
①本实验用的是78%的硫酸,为何不用浓硫酸?________________________________。
②亚硫酸钠溶液的作用是____________________________________________________。
③该实验中会产生许多生成有机物的副反应,写出化学方程式:________________________________(举一例)。
④本次实验只收集到5 mL溴乙烷,比理想产量约10 mL少,原因是溴乙烷易挥发的缘故,为了减少其损失,你认为可采取什么措施?________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com