
分析 X、Y、Z、D、E、G六种短周期元素的原子序数依次递增,D、E属于同族元素,G的单质的水溶液和ED2均有漂白性,故G为Cl元素,ED2为SO2,则E为S,D为O.又X、Y、D元素元素原子中电子层数与未成对电子数均相等,X、Y、D原子序数依次递增,故X为H,Y为C,Z为N元素;R元素的M层全满,N层只有1个电子,则为Cu元素.
解答 解:X、Y、Z、D、E、G六种短周期元素的原子序数依次递增,D、E属于同族元素,G的单质的水溶液和ED2均有漂白性,故G为Cl元素,ED2为SO2,则E为S,D为O.又X、Y、D元素元素原子中电子层数与未成对电子数均相等,X、Y、D原子序数依次递增,故X为H,Y为C,Z为N元素;R元素的M层全满,N层只有1个电子,则为Cu元素.
(1)Cu位于周期表第四周期ⅠB族,外围电子构型为:3d104s1,属于ds区元素,
同周期从左到右电负性依次增大,故电负性由小到大顺序为:C<N<O,
故答案为:ds;C<N<O;
(2)H3O+中O原子价层电子对个数=3+$\frac{1}{2}$(6-1-3×1)=4,且该微粒中含有一个孤电子对,所以水合氢离子为三角锥形,氧原子杂化方式为sp3;
故答案为:sp3;三角锥形;
(3)硫酸铜和过量氨水反应先生成蓝色沉淀,后氢氧化铜溶解在氨水中生成络离子,得到深蓝色溶液,有关离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O;
(4)二氧化硫有还原性,铜离子有氧化性,所以二氧化硫和氯化铜发生氧化还原反应生成氯化亚铜和硫酸,离子反应方程式为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+,
故答案为:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+SO42-+4H+.
点评 本题以元素推断为载体,综合考查原子核外电子排布、元素周期表、原子结构、空间构型与杂化方式判断、离子方程式的书写等,有利于培养学生对知识的迁移运用能力.


科目:高中化学 来源: 题型:选择题
| A. | 放电时NaTi2(PO4)3在正极发生还原反应 | |
| B. | 充电过程中阳极反应式为:2NaNiFeⅢ(CN)6+2Na++2e-=2Na2NiFeⅡ (CN)6 | |
| C. | 放电时负极材料中的Na+脱离电极进入溶液,同时溶液中的Na+嵌入到正极材料中 | |
| D. | 该电池在较长时间的使用过程中电解质溶液中Na+的浓度基本保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
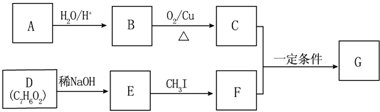
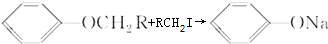
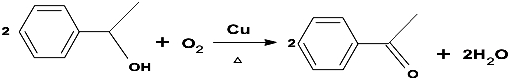 .
. (不要求立体异构).
(不要求立体异构).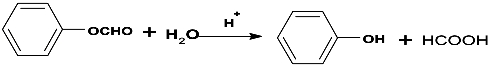 .
.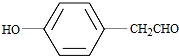 .(写结构简式)
.(写结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:推断题
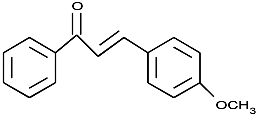
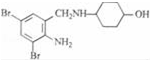 ,不考虑立体异构)是临床上使用广泛的药物.如图所示的为其多条合成路线中的一条(反应试剂和反应条件均未标出)
,不考虑立体异构)是临床上使用广泛的药物.如图所示的为其多条合成路线中的一条(反应试剂和反应条件均未标出)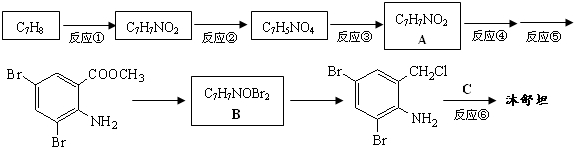
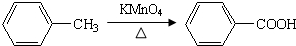 ,完成下列填空:
,完成下列填空: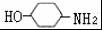 +2
+2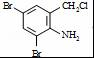 +K2CO3→2
+K2CO3→2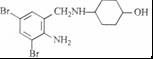 +2KCl+CO2↑+H2O.
+2KCl+CO2↑+H2O.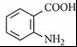 B
B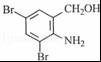 .
.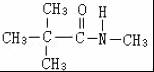 、
、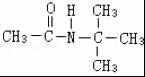 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子浓度大小关系为c(Na+)>c(Cl-)>c(HS-)>c(H+)>c(OH-) | |
| B. | c(Na+)+c(H+)=c(Cl-)+c(HS-)+c(OH-) | |
| C. | c(HS-)+c(H2S)=0.04 mol/L | |
| D. | c(H+)-c(OH-)=0.02-c(H2S)+c(S2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 实验现象 | 结 论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Cu>Fe |
B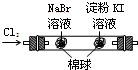 | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 白色固体先变为淡黄色,后变为黑色(Ag2S) | 溶解性:AgCl>AgBr>Ag2S |
D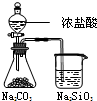 | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 酸性:HCl>H2CO3>H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
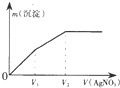 往含I-和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3溶液的体积V( AgN03)的关系如图所示.已知:Ksp(AgCl)=1.8×l0-10,Ksp( AgI)=l.5×l0-16则原溶液中$\frac{c({l}^{-})}{c(C{l}^{-})}$的比值为( )
往含I-和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3溶液的体积V( AgN03)的关系如图所示.已知:Ksp(AgCl)=1.8×l0-10,Ksp( AgI)=l.5×l0-16则原溶液中$\frac{c({l}^{-})}{c(C{l}^{-})}$的比值为( )| A. | $\frac{{V}_{2}-{V}_{1}}{{V}_{1}}$ | B. | $\frac{{V}_{1}}{{V}_{2}}$ | C. | $\frac{{V}_{1}}{{V}_{2}-{V}_{1}}$ | D. | $\frac{{V}_{2}}{{V}_{1}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| B. | 含钙、钡、铂等金属元素的物质有绚丽的颜色,可用于制造焰火 | |
| C. | 石油裂解、煤的气化、海水制镁都包含化学变化 | |
| D. | 工业上为了加快分离胶体中的电解质杂质,常在渗析袋外施加电场,使电解质离子透过半透膜向两极移动,该操作是应用胶体的电泳原理 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com