
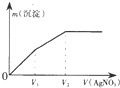
 往含I-和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3溶液的体积V( AgN03)的关系如图所示.已知:Ksp(AgCl)=1.8×l0-10,Ksp( AgI)=l.5×l0-16则原溶液中$\frac{c({l}^{-})}{c(C{l}^{-})}$的比值为( )
往含I-和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3溶液的体积V( AgN03)的关系如图所示.已知:Ksp(AgCl)=1.8×l0-10,Ksp( AgI)=l.5×l0-16则原溶液中$\frac{c({l}^{-})}{c(C{l}^{-})}$的比值为( )| A. | $\frac{{V}_{2}-{V}_{1}}{{V}_{1}}$ | B. | $\frac{{V}_{1}}{{V}_{2}}$ | C. | $\frac{{V}_{1}}{{V}_{2}-{V}_{1}}$ | D. | $\frac{{V}_{2}}{{V}_{1}}$ |
分析 由Ksp可知,先生成AgI沉淀,则0~V1消耗的硝酸银发生I-+Ag+=AgI↓,V1~V2发生Cl-+Ag+=AgCl↓,以此计算.
解答 解:由Ksp(AgCl)=1.8×l0-10,Ksp( AgI)=l.5×l0-16,可知AgI更难溶,则先生成AgI沉淀,则0~V1消耗的硝酸银发生I-+Ag+=AgI↓,V1~V2发生Cl-+Ag+=AgCl↓,n(I-)=V1c( AgN03),n(Cl-)=(V2-V1)c( AgN03),且氯离子、碘离子在同一溶液中,所以原溶液中$\frac{c({l}^{-})}{c(C{l}^{-})}$的比值为$\frac{{V}_{1}}{{V}_{2}-{V}_{1}}$,
故选C.
点评 本题考查难溶电解质及相关计算,为高频考点,把握AgI先生成、离子反应与图象的对应关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
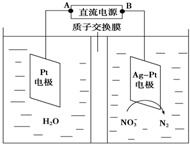 目前废水处理中的除氮技术,通常是把水中的氨氮污染物先降解为NO3-或NO2-,然后再用电解的方法除去NO3-和NO2-,如图是电化学降解硝酸盐的原理,关于该原理的说法正确的是( )
目前废水处理中的除氮技术,通常是把水中的氨氮污染物先降解为NO3-或NO2-,然后再用电解的方法除去NO3-和NO2-,如图是电化学降解硝酸盐的原理,关于该原理的说法正确的是( )| A. | 若以铅蓄电池做电源进行电解,Pt电极为阴极 | |
| B. | 电解过程中H+向正极移动 | |
| C. | 若电解过程中转移1mol电子,则交换膜两侧电解液的质量变化差为7.2g | |
| D. | 理论上电解过程中阴、阳两极产生的气体在相同条件下体积比为5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.0g甲醛和甲酸甲酯的混合物中含有的原子数为0.4NA | |
| B. | 常温下,1L0.1mol•L-1CuSO4溶液中粒子总数小于0.2NA | |
| C. | 1 mol冰醋酸和1 mol乙醇在浓硫酸加热下充分反应生成H2O个数为NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | R | X | Y | W |
| 原子半径/nm | 0.077 | 0.074 | 0.186 | 0.099 |
| 主要化合价 | +4、-4 | -2 | +1 | +7、-1 |
| A. | 简单的离子半径由小到大排序:Y、X、W | |
| B. | X的气态氢化物的稳定性一定比R的强 | |
| C. | R、X和Y可以组成含共价键的离子化合物 | |
| D. | 在R、X、W的氢化物中,X的沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”是指从泔水中提取的油脂,它也是一种资源,但不能食用,可用于生产燃料油或用于制肥皂 | |
| B. | 媒体曝光的制造问题胶囊的工业明胶的主要成分是蛋白质 | |
| C. | 塑化剂DEHP是邻苯二甲酸(2─乙基己基)二酯,对人体无害可用作食品添加剂 | |
| D. | PM2.5是指大气中直径≤2.5×10-6m的颗粒物(气溶胶),可通过加水吸收后再用半透膜渗析的方法分离PM2.5微粒与可溶性吸附物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子排布式为:1s22s22p63s23p63d34s2 | |
| B. | 该元素为VB | |
| C. | 元素为ⅢB族元素 | |
| D. | 该元素属于过渡元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
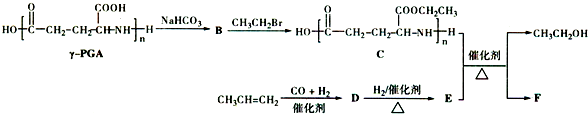
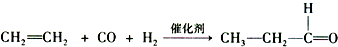
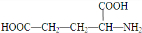 .
.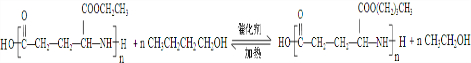 .
.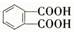 )反应生成的产物DBP(C16H22O4)是广泛使用的增塑剂之一.DBP有多种同分异构体,其中符合下列条件的DBP的同分异构体有12种,写出其中一种同分异构体的结构简式
)反应生成的产物DBP(C16H22O4)是广泛使用的增塑剂之一.DBP有多种同分异构体,其中符合下列条件的DBP的同分异构体有12种,写出其中一种同分异构体的结构简式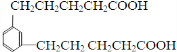 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol的CaO2含阴阳离子总数是0.3NA | |
| B. | 0.1 mol苯乙烯含π键的数目为0.4NA | |
| C. | 1 L 1mol/L的Na2CO3溶液中含阴阳离子数小于3NA | |
| D. | 2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com