
【题目】2019年诺贝尔化学奖颁给了日本吉野彰等三人,以表彰他们对锂离子电池研发的卓越贡献。
(1)自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷锂铝石等。为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈________,可以认为存在锂元素。
A.紫红色 B.紫色 C.黄色
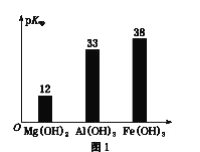
(2)工业中利用锂辉石(主要成分为LiAlSi2O6,还含有FeO、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如下:
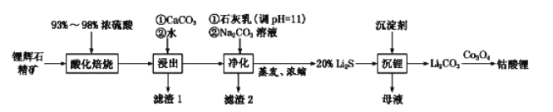
已知:部分金属氢氧化物的pKsp(pKsp=-lgKsp)的柱状图如图1。
回答下列问题:
①锂辉石的主要成分为LiAlSi2O6,其氧化物的形式为________。
②为提高“酸化焙烧”效率,常采取的措施是________。
③向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为_______。(已知:完全沉淀后离子浓度低于1×l0-5)mol/L)
④“沉锂”过程所获得的“母液”中仍含有大量的Li+,可将其加入到“___________”步骤中。
⑤Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为__________
(3)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LiCoO2+C6 ![]() LixC6+Li1-xCoO2 ,其工作原理如图2。
LixC6+Li1-xCoO2 ,其工作原理如图2。
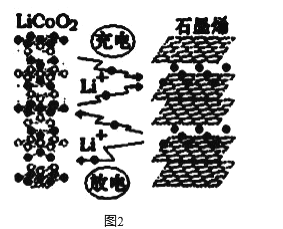
下列关于该电池的说法正确的是___________(填字母)。
A.电池反应式中过程1为放电过程
B.该电池若用隔膜可选用质子交换膜
C.石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
D.充电时,LiCoO2 极发生的电极反应为LiCoO2-xe-=xLi++Li1-xCoO2
E.对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
【答案】A Li2O·Al2O3·4SiO2 将矿石细麿(搅拌、升高温度或其他合理答案) 4.7 净化 6Li2CO3+4Co3O4+O2![]() 12LiCoO2+6CO2 CD
12LiCoO2+6CO2 CD
【解析】
(1)锂元素焰色反应是紫红色;
(2) ①将硅酸盐改写成氧化物形式,按活泼金属氧化物、不活泼金属氧化物、二氧化硅、水的次序写,保证原子总数、化合价不变,按化合价分别写化学式,如有多个原子,在前面加上系数,使之成为倍数;
②结合影响反应速率的因素分析;
③结合pKsp及沉淀完全时溶液中离子浓度低于1×l0-5mol/L计算即可;
④由流程可知将净化后的溶液蒸发、浓缩得到Li2S;
⑤Li2CO3与Co3O4在有氧气参与的情况下,高温焙烧生成钴酸锂和CO2,结合电子守恒和原子守恒写出发生反应的化学方程式;
(3) 根据电池反应式知,负极反应式为LixC6-xe-=C6+xLi+、正极反应式为Li1-xCoO2+xLi++xe-=LiCoO2,充电时,阴极、阳极反应式与负极、正极反应式正好相反,根据二次电池的工作原理结合原电池和电解池的工作原理来解答。
(1) 锂元素焰色反应颜色为紫红色,故答案为A;
(2) ①LiAlSi2O6可表示为:Li2OAl2O34SiO2;
②采取将矿石细麿,酸化时并搅拌,以及升高温度等措施,可提高“酸化焙烧”效率;
③已知pKsp[Al(OH)3]=33,pKsp[Fe(OH)3]=38,则Al3+溶液完全时溶液中c(OH-)=![]() mol/L≈10-9.3mol/L,此时溶液的pH=4.7;而Fe3+溶液完全时溶液中c(OH-)=
mol/L≈10-9.3mol/L,此时溶液的pH=4.7;而Fe3+溶液完全时溶液中c(OH-)=![]() mol/L=10-11mol/L,此时溶液的pH=3,故控制pH至少为4.7时,能使Fe3+、A13+完全沉淀;
mol/L=10-11mol/L,此时溶液的pH=3,故控制pH至少为4.7时,能使Fe3+、A13+完全沉淀;
④由流程可知将净化后的溶液蒸发、浓缩得到Li2S ,则应将“沉锂”过程所获得的“母液”加入到净化步骤中;
⑤Li2CO3与Co3O4在有氧气参与的情况下,高温焙烧生成钴酸锂和CO2,则发生反应的化学方程式为6Li2CO3+4Co3O4+O2![]() 12LiCoO2+6CO2;
12LiCoO2+6CO2;
(3) A.过程1为锂离子嵌入石墨中,结合图②可知为充电过程,故A错误;
B.由电池反应,则需要锂离子由负极移向正极,所以该电池不可选用质子交换膜,故B错误;
C.石墨烯超强电池,该材料具有极佳的电化学储能特性,从而提高能量密度,故C正确;
D.充电时,LiCoO2极是阳极,发生失电子的氧化反应,电极反应式为:LiCoO2- xe- =Li1-xCoO2+xLi+,故D正确;
E.由图②可知,充电时锂离子嵌入石墨中,故E错误;
故答案为CD。


科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g);ΔH= -270 kJ/mol,下列说法正确的是( )
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1mol H2与1mol F2反应生成2mol液态HF放出的热量小于270kJ
C.在相同条件下,1mol H2与1mol F2的能量总和大于2mol HF气体的能量
D.该反应中的能量变化可用如图来表示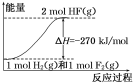
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研团队发现苯乙烯与开链醚可实现如下的转化反应,关于该反应,下列说法不正确的是

A.M属于芳香烃
B.N的同分异构中可能有醛类化合物
C.P分子中只含有两种含氧官能团
D.若R1、R2均为甲基,则P的分子式为C12H16O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+B(g) ![]() 2C(g)+D(g)。若最初加入的A和B都是8 mol,在前10秒钟A的平均反应速率为0.12 mol/(Ls),则10秒钟时,容器中B的物质的量是
2C(g)+D(g)。若最初加入的A和B都是8 mol,在前10秒钟A的平均反应速率为0.12 mol/(Ls),则10秒钟时,容器中B的物质的量是
A.5.6 molB.6.8 molC.2.4 molD.3.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,为应对温室气体排放问题和日益增长的能源需求问题,CO2综合利用技术作为潜在的解决方案受到了研究者的广泛关注。请按照要求回答问题
(1)CO常用于工业冶炼金属,下图是在不同温度下CO还原四种金属氧化物达平衡后气体中![]() 与温度(t)的关系曲线图。下列说法正确的是________。(填序号)
与温度(t)的关系曲线图。下列说法正确的是________。(填序号)

A 工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量
B CO不适宜用于工业冶炼金属铬(Cr)
C 工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率
D CO还原PbO2的反应△H>0
(2)一定条件下Pd-Mg/SiO2催化剂可使CO2 “甲烷化”变废为宝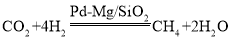 ,最佳催化温度是200℃~300℃左右,超过300℃催化剂会完全失活、反应停止。向密闭容器通入v(CO2):v(H2)=1:4的反应气体,常温进料开始加热,画出生成甲烷的量随温度的变化曲线_________。
,最佳催化温度是200℃~300℃左右,超过300℃催化剂会完全失活、反应停止。向密闭容器通入v(CO2):v(H2)=1:4的反应气体,常温进料开始加热,画出生成甲烷的量随温度的变化曲线_________。
(3)在载人航天器中应用电化学原理,以Pt为阳极,Pb(CO2的载体)为阴极KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,则阴极的电极反应式为___________;室温下H2CO3电离常数约为K1=4×10-7,K2=5×10-11,则0.025 mol·L-1的H2CO3溶液的pH约等于__________(不考虑第二步电离和H2O的电离)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知稀溶液中①H+(aq)+OH-(aq)![]() H2O(l) △H1=-57.3kJ·mol-1;
H2O(l) △H1=-57.3kJ·mol-1;
②![]() Ba(OH)2(aq)+
Ba(OH)2(aq)+ ![]() H2SO4(aq)=
H2SO4(aq)=![]() BaSO4(s)+H2O(l) △H2下列结论正确的是
BaSO4(s)+H2O(l) △H2下列结论正确的是
A.中和反应的△H=-57.3kJmol-1B.△H2<△H1
C.△H2>△H1D.中和热的数值与实际发生反应的酸碱量有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1 mol X气体和0.5 mol Y气体混合于2 L密闭容器中,发生如下反应:3X(g)+Y(g)![]() nZ(g)+2W(g),2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
nZ(g)+2W(g),2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
(1)前2 min内,用X表示的平均反应速率________;
(2)2 min末时Y的转化率________;
(3)化学方程式中Z的化学计量数n________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种无色、易溶于水和具有强还原性的液体,沸点为113.5℃。广泛应用于医药等领域。工业上利用尿素法生产肼,同时得到副产品Na2CO3·10H2O,其工艺流程如下:
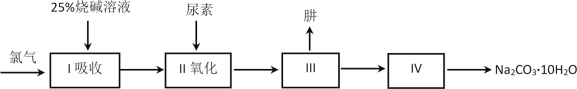
完成下列填空:
制肼过程的反应为:CO(NH2)2 + NaClO + 2NaOH → N2H4 + Na2CO3 + NaCl + H2O。
(1)将Cl2通入水中,所得溶液中具有氧化性的微粒是______________________。
(2)写出I吸收时发生反应的离子方程式__________________________。为保证后续反应充分,理论上需要通入氯气与烧碱溶液的质量之比应为71:____。
(3)已知氯酸钠有一定的氧化性。而在氯气和烧碱反应时,需控制反应温度防止氯酸钠生成。原因是______、____________。
(4)上述流程合成的Na2CO3·10H2O中含有杂质。若要检验杂质的阴离子,选择的试剂是________________________。
(5)Na2CO3·10H2O的纯度可用气体法测定,在一定温度和压强下,还需要测定的物理量___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用如图所示的实验装置进行实验。

(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有______。
(2)若对调B和C装置的位置,_____(填“可能”或“不可能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20molL-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是______。
②设计1号试管实验的作用是______。
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入______溶液显蓝色。
实验三 测定饱和氯水中氯元素的总量
(4)根据下列资料,为该小组设计一个简单可行的实验方案(不必描述操作过程的细节):_____。
资料:①次氯酸会破坏酸碱指示剂;
②次氯酸或氯水可被SO2、H2O2和FeCl2等物质还原成Cl-。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com