
【题目】把1 mol X气体和0.5 mol Y气体混合于2 L密闭容器中,发生如下反应:3X(g)+Y(g)![]() nZ(g)+2W(g),2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
nZ(g)+2W(g),2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
(1)前2 min内,用X表示的平均反应速率________;
(2)2 min末时Y的转化率________;
(3)化学方程式中Z的化学计量数n________。
【答案】(6分)
(1)0.075 mol/(L·min) (2)20% (3) 4
【解析】
试题根据三段式解题 3X(g)+Y(g)=nZ(g)+2W(g)
起始浓度(mol/L) 0.5 0.25 0 0
变化浓度(mol/L) 0.15 0.05 0.05n 0.1
平衡浓度(mol/L) 0.35 0.2 0.05n 0.1
(1)根据2 min末生成0.2 mol W ,则X反应掉0.3mol,v(X)=0.3mol÷(2L×2min)=0.075 mol/(L·min)
(2)α(Y)=0.05÷0.25×100%=20%
(3)根据V (Z)=△C÷t=0.05nmol/L÷2min=0.1 mol/(L·min),解得n=4。


 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
【题目】磺化聚苯醚(SPPO)质子交换膜在燃料电池领域有广阔的应用前景。合成聚苯醚(PPO)并将其改性制备SPPO的路线如下:
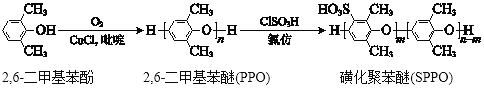
下列说法不正确的是
A. 2,6-二甲基苯酚能与饱和溴水发生取代反应
B. 常温下2,6-二甲基苯酚易溶于水
C. 2,6-二甲基苯酚与O2发生氧化反应生成PPO
D. PPO合成SPPO的反应是: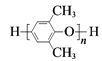 +mClSO3H
+mClSO3H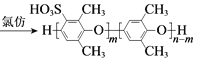 +mHCl
+mHCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. Na与H2O的反应是熵增的放热反应,该反应能自发进行
B. 向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液,一支试管中产生黄色沉淀,另一支无明显现象,则可证明Ksp(AgI)<Ksp(AgCl)
C. Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s) ![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
D. FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
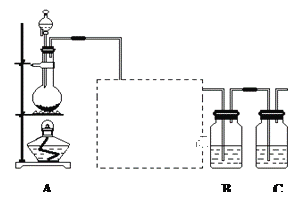
(1)装置A的分液漏斗中盛装的试剂是___________,烧瓶中加入的试剂是___________,发生的离子反应方程式_____________________;
(2)虚线框内是一个装有未知试剂的广口瓶,该试剂是___________,说明装置的作用________________;
(3)装置B中盛放的试剂是______________(选填下列所给试剂的字母),实验现象为___________________,化学反应方程式是__________________________________;
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁。可说明氯比硫非金属性强的是_________;
A.全部 B.②③④⑥ C.①②④⑤⑥ D.除①以外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取并收集氯气的装置如图所示,请回答下列问题
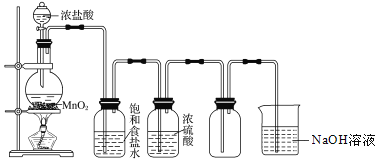
(1)气体发生装置中进行的反应化学方程式是______。
(2)在装置中:①饱和食盐水的作用是______,②浓硫酸的作用是______。
(3)化学实验中检验是否有![]() 产生常用湿润的淀粉
产生常用湿润的淀粉![]() 试纸
试纸![]() 如果有
如果有![]() 产生,可观察到的现象是______。
产生,可观察到的现象是______。
(4)写出尾气吸收装置中进行的反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应PCl5(g)![]() PCl3(g)+Cl2(g),523K时,将10mol PCl5注入容积为2L的密闭容器中,平衡时压强为原来的1.5倍。
PCl3(g)+Cl2(g),523K时,将10mol PCl5注入容积为2L的密闭容器中,平衡时压强为原来的1.5倍。
(1)该温度下该反应的平衡常数K为________
(2)PCl5的平衡转化率为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增大,且均不大于20。Y元素原子的最外层电子 数是内层电子数的3倍,Z元素原子的最外层电子数是最内层电子数的一半。甲是W、X两种元素形成的简单化合物,水溶液呈碱性,乙是Y元素的单质。在工业生产中它们有如下转化关系。下列叙述正确的是

A. 原子半径的大小W<X<Y<Z
B. 戊与丁反应过程中氧化剂与还原剂的物质的量之比为1:2
C. Y与Z形成的所有化合物中只存在离子键
D. X元素的氧化物对应的水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用与水解原理无关的是
A. 实验室盛放碳酸钠溶液的试剂瓶不能用玻璃塞
B. 泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将两者混合就可产生大量二氧化碳的泡沫
C. 浓硫化钠溶液有臭味
D. 可用碳酸钠与醋酸制取少量二氧化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com