
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
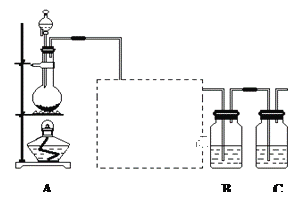
(1)装置A的分液漏斗中盛装的试剂是___________,烧瓶中加入的试剂是___________,发生的离子反应方程式_____________________;
(2)虚线框内是一个装有未知试剂的广口瓶,该试剂是___________,说明装置的作用________________;
(3)装置B中盛放的试剂是______________(选填下列所给试剂的字母),实验现象为___________________,化学反应方程式是__________________________________;
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁。可说明氯比硫非金属性强的是_________;
A.全部 B.②③④⑥ C.①②④⑤⑥ D.除①以外
【答案】浓HCl MnO2 MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O 饱和食盐水 除去Cl2中混有的HCl A 有黄色沉淀生成 Cl2+S2-=S↓+2Cl- B
Mn2++Cl2↑+2H2O 饱和食盐水 除去Cl2中混有的HCl A 有黄色沉淀生成 Cl2+S2-=S↓+2Cl- B
【解析】
(1)从实验室制取氯气的原理分析;
(2)制取氯气时,浓盐酸易挥发,则虚线框内的装置图中所加试剂为除HCl气态,则为饱和食盐水;
(3)氯气与硫化钠反应生成单质硫,氯气为氧化剂、硫为氧化产物,氯的氧化性大于硫;
(4)氯比硫非金属性强,则其气态氢化物的稳定性越强,反应越容易;其最高价氧化物对应水化物的酸性越强;与变价金属反应生成高价态的非金属性较强。
(1)根据实验目的可知,验证氯元素的非金属性比硫元素的非金属性强,则装置A为制取氯气的装置,其反应原理为浓盐酸与二氧化锰共热,则分液漏斗中盛有浓盐酸,其反应的离子方程式为:MnO2+ 4H+ +2Cl-(浓)![]() Mn2+ + Cl2↑+2H2O,故答案为:浓HCl;MnO2;MnO2+4H++2Cl-
Mn2+ + Cl2↑+2H2O,故答案为:浓HCl;MnO2;MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)制取氯气时,浓盐酸易挥发,则虚线框内的装置图中所加试剂为除HCl气态,则为饱和食盐水,故答案为:饱和食盐水;除去Cl2中的HCl气体;
(3)氯气与硫化钠反应生成单质硫,氯气为氧化剂、硫为氧化产物,氯的氧化性大于硫,方程式为:Na2S+Cl2=2NaCl+S↓,离子方程式为:Cl2+S2-=S↓+2Cl-,现象为:有黄色沉淀生成,故答案为:A;有黄色沉淀生成;Cl2+S2-=S↓+2Cl-;
(4)氯比硫非金属性强,则其气态氢化物的稳定性越强,反应越容易,则④正确;其最高价氧化物对应水化物的酸性越强,则①错误、②正确;与变价金属反应生成高价态的非金属性较强,则⑥正确;对应离子的还原性越弱,则③正确;综上正确为:②③④⑥,答案为:B。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】已知元素A、B、C、D和E的原子序数依次增大。A、B、C、D四种元素核电荷数均小于20,A、B同主族;B、C、D元素的基态原子具有相同的能层数,它们的基态原子中p能级上未成对电子数分别为1、3、1;E是周期表中(除放射性元素外)第一电离能最小的元素。回答下列问题:
(1)写出下列元素的符号:A 、E 。
(2)C元素的价电子排布图为: ;
该排布遵循的原理主要有: (答完整得分)。
(3)C、D元素形成的化合物主要有: (填化学式,答完整得分);其中相对分子质量较小的分子为 分子(填“极性”或“非极性”),该分子的空间构型为 ,中心原子的杂化方式是 。
(4)化合物BD3的熔点190℃、沸点182.7℃,那么BD3的晶体类型为 ;事实上,在BD3的化合物中往往以B2D6的形式存在,该形式的存在是由于 形成的。(选填“氢键”、“范德华力”、“离子键”、“配位键”)
(5)下图为几种晶胞(或晶胞的1/8)示意图,其中![]() 和
和![]() 代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。
代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。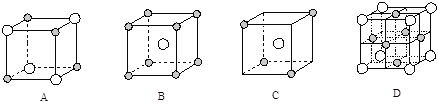
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将5.6g铁和4.6g钠分别与100m L 1mol/L的盐酸反应 ,则放出H2的体积( )
A. 铁的多 B. 钠的多 C. 铁和钠放出一样多 D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积的关系如图,下列说法正确的是( )
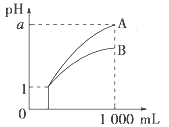
①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A. ①④ B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是

A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1 mol X气体和0.5 mol Y气体混合于2 L密闭容器中,发生如下反应:3X(g)+Y(g)![]() nZ(g)+2W(g),2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
nZ(g)+2W(g),2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
(1)前2 min内,用X表示的平均反应速率________;
(2)2 min末时Y的转化率________;
(3)化学方程式中Z的化学计量数n________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废水中氨态氮以NH3H2O、NH3和NH4+的形式存在,废水脱氮已成为主要污染物减排和水体富营养化防治的研究热点。
Ⅰ.沉淀法
向废水中投入MgCl2和Na2HPO4,生成MgNH4PO46H2O沉淀,可将氨态氮含量降至10mg·L1以下。
(1)NH3的电子式:______。
(2)废水中的NH3H2O转化为MgNH4PO46H2O的离子方程式是______。

(3)16℃时,向废水中加入MgCl2和Na2HPO4,使镁、氮、磷物质的量之比为1︰1︰1,沉淀过程中的pH对剩余氨态氮浓度的影响如图。欲使剩余氨态氮浓度低于10mg·L1,pH的适宜范围是______,pH偏大或者偏小均不利于MgNH4PO46H2O的生成,原因是______。
Ⅱ.微波—氧化法
(4)仅对废水进行微波加热,pH对氨态氮脱出的影响如下表。
溶液pH | 6~7 | 8~9 | 10~11 | 11~12 |
剩余氨态氮浓度(mg·L1) | 156 | 100 | 40 | 14 |
表中数据表明:pH增大有利于废水中化学平衡______(用化学用语表示)的移动。
(5)微波协同CuO和H2O2除去氨态氮
①其他条件相同,取相同体积的同一废水样品,微波10min,剩余氨态氮浓度与一定浓度H2O2溶液添加量的关系如下图。据图推测CuO在氨态氮脱除中可能起催化作用,理由是______。

②微波协同CuO有利于H2O2除去氨态氮。该条件下,H2O2将NH3氧化为N2的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示可逆反应:mA(g) + nB(g) ![]() xC(g) ΔH = Q kJ/mol;在不同温度、压强下反应物A的转化率的变化情况。下列对于反应的热效应Q和反应方程式A、B、C的化学计量数的判断中,正确的是
xC(g) ΔH = Q kJ/mol;在不同温度、压强下反应物A的转化率的变化情况。下列对于反应的热效应Q和反应方程式A、B、C的化学计量数的判断中,正确的是

A. 上述反应是放热反应
B. 上述反应是吸热反应
C. m+n<x
D. m+n>x
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,将4.48L的NO2和NO组成的混合气体通入100mL的水中,气体体积缩小为2.24L,假设溶液的体积不变,则下列说法中错误的是( )
A.所得溶液中溶质的物质的量浓度为1.0mol·L-1
B.剩余气体中氮元素与氧元素的质量为7∶8
C.原混合气体中NO2和NO的体积比为1∶1
D.反应过程中转移的电子总数为0.1mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com