
属于加成反应的是( )
A.乙炔通入溴水中使溴水褪色
B.乙烯使酸性高锰酸钾溶液褪色
C.四氯化碳与溴水混合振荡,静置后溴水褪色
D.酒精和浓硫酸混合加热至170℃得到乙烯
科目:高中化学 来源:2014年高考化学苏教版总复习5-3微粒间相互作用力与物质多样性练习卷(解析版) 题型:选择题
下列物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
A.CO2、共价键、共价化合物
B.MgCl2、离子键和共价键、离子化合物
C.H2O、离子键、共价化合物
D.NaOH、离子键和共价键、共价化合物
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 9-3 人工合成有机化合物练习卷(解析版) 题型:选择题
下列有关说法正确的是( )
A.凡含有食品添加剂的食物对人体健康均有害,不宜食用
B.可用米汤检验含碘盐中的碘酸钾(KIO3)
C.涤纶、绵纶、棉花、羊毛、蚕丝等都是天然纤维素
D.纤维素属于糖类,不能够直接被消化成为人体的营养物质
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 9-1 化石燃料与有机化合物练习卷(解析版) 题型:实验题
用A、B、C三种装置都可制取溴苯,请仔细分析三套装置,然后回答下列问题:
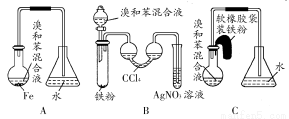
(1)写出三个装置中都发生反应的化学方程式 、 ;写出B试管中发生反应的化学方程式 。
(2)装置A、C中长导管的作用是 。
(3)B、C装置已连接好,并进行了气密性检验,也装入了合适的药品,接下来要使反应开始,对B应进行的操作是 ,
对C应进行的操作是 。
(4)A中存在加装药品和及时密封的矛盾,因而在实验中易造成的不良后果是 。
(5)B中采用了双球吸收管,其作用是 ;反应后双球管中可能出现的现象是 ;双球管内液体不能太多,原因是 。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行,这两个缺点是 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 9-1 化石燃料与有机化合物练习卷(解析版) 题型:选择题
增加汽油中支链烷烃、芳香烃和环烷烃的比例是从根本上提高汽油质量的措施,常用催化重整。关于以下两个在催化重整时发生的反应:
①
②
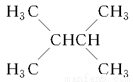
下列叙述不正确的是( )
A.石油分馏后得到的汽油等轻质油远不能满足需求,故常用裂化等方法生产更多的轻质油
B.使用含铅抗爆剂,会导致铅污染,故目前已禁止使用
C.①②均为消去反应
D.①②反应过程中有机物碳原子数均没有发生变化
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:填空题
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适的氧化剂,使Fe2+被氧化为Fe3+,下列物质可采用的是________。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A.NaOH B.KOH C.CuO D.Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4不一定能达到除去Fe3+而不损失Cu2+的目的。乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________。(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
已知AgI为黄色沉淀,AgCl为白色沉淀。25°C时,AgI饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCl饱和溶液中c(Ag+)为1.30×10-5mol·L-1。若在5 mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01mol·L-1的AgNO3溶液,则下列叙述中不正确的是 ( )
A.溶液中所含溶质的离子浓度大小关系为: c(K+)>c(NO3—)>c(Cl-)>c(I-)>c(Ag+)
B.溶液中先产生的是AgI沉淀
C.AgCl的Ksp的数值为1.69×10-10
D.若在AgI悬浊液中滴加少量的KCl溶液,黄色沉淀不会转变成白色沉淀
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-3 盐类的水解练习卷(解析版) 题型:选择题
下列离子方程式中,能正确表示盐的水解反应的是( )
A.NH4++H2O NH3·H2O+H+
NH3·H2O+H+
B.Fe3++3H2O Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
C.S2-+2H2O H2S+2OH-
H2S+2OH-
D.Br-+H2O HBr+OH-
HBr+OH-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:填空题
甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。

①已知100°C时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为________。
②图中的p1________p2(填“<”“>”或“=”),100°C时平衡常数为________。
③在其他条件不变的情况下降低温度,逆反应速率将________(填“增大”“减小”或“不变”)。
(2)在压强为0.1 MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g)……Ⅱ。
CH3OH(g)……Ⅱ。
④该反应的ΔH________0,ΔS________0(填“<”“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
ⅰ | 150 | ? | 0.1 |
ⅱ | ________ | ________ | 5 |
ⅲ | 350 | ________ | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com