
【题目】常温下,已知Ka1(H2CO3)=4.3×10-7, Ka2(H2CO3)=5.6×10-11。 某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述错误的是( )
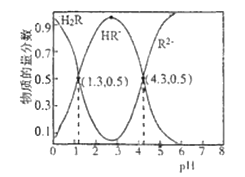
A.H2R的一级电离常数Ka1的数量级为10-2
B.在pH=4.3的溶液中:3c(R2-)=c(Na+ )+c(H+)-c(OH-)
C.等体积、等浓度的NaOH溶液与H2R溶液混合后,溶液中: c(R2- )>c(H2R)
D.向Na2CO3溶液中加入少量H2R溶液,发生的反应是: CO32- +H2R=HCO3-+HR-
【答案】D
【解析】
二元酸H2X存在两步电离:H2R![]() HR -+H+,Ka1=
HR -+H+,Ka1=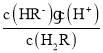 =1.0×10-1.3[根据图上第一个交点,c(H2R)=c(HR-),那么Ka1= c(H+ )= 1.0×10-1.3];HR-
=1.0×10-1.3[根据图上第一个交点,c(H2R)=c(HR-),那么Ka1= c(H+ )= 1.0×10-1.3];HR- ![]() R 2- + H+,Ka2=
R 2- + H+,Ka2=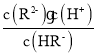 =1.0×10-4.3[根据图上的第二个交点,c(R2-)=c(HR-),那么Ka2=c(H+ )= 1.0×10-4.3];R2-发生两步水解:R2- + H2O
=1.0×10-4.3[根据图上的第二个交点,c(R2-)=c(HR-),那么Ka2=c(H+ )= 1.0×10-4.3];R2-发生两步水解:R2- + H2O![]() HR -+OH-,
HR -+OH-,![]() ;HR -+ H2O
;HR -+ H2O![]() H2R+ OH-,
H2R+ OH-,![]() =
=![]() 。
。
A. 根据分析,H2R的一级电离常数Ka1=1.0×10-1.3,则数量级为10-2,A项正确;
B. 如图在pH=4.3时溶液中c(R2-) = c(HR-),溶液中电荷守恒为c(Na+ )+c(H+)=2c(R2-) + c(HR-)+c(OH-),故3c(R2-)=c(Na+ )+c(H+)-c(OH-),B项正确;
C. 等体积、等浓度的NaOH溶液与H2R溶液混合后,二者恰好反应生成NaHR,HR-可以电离也可以水解,由于Ka2=1.0×10-4.3大于Kh2=![]() ,所以以电离为主,溶液显酸性,则电离产物c(R2- )大于水解产物c(H2R),C项说法正确;
,所以以电离为主,溶液显酸性,则电离产物c(R2- )大于水解产物c(H2R),C项说法正确;
D. 根据弱酸的电离平衡常数越大酸性越强,由于Ka1(H2R)>Ka2(H2R)>Ka1(H2CO3)>Ka2(H2CO3),可得酸性:H2R>HR>H2CO3>HCO3,可得酸根离子结合氢离子能力:CO32->HCO3>R2->HR;那么向Na2CO3溶液中加入少量H2R溶液,因为是少量酸性溶液,只能将CO32-转化为HCO3,酸性不足还不能生成HR,仍然以R2-形式存在,故发生的反应是:2CO32- +H2R= 2HCO3+ R2-,D项错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】(1)比较结合e-能力的相对强弱:Cl2__________S(填“>”或“<”);用一个离子方程式说明Cl2和S结合e-能力的相对强弱_______。
(2)KCN 是离子化合物,各原子均满足8 电子稳定结构。写出 KCN的电子式______。
(3)在常压下,CBr4的沸点(190℃)比CCl4的沸点(76.8℃)高。主要原因是 ____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室通常用氧化剂+浓盐酸![]() 金属氯化物+水+氯气的原理制取少量Cl2。现将一定质量的NaClO放入100 mL 10.00 mol·L-1的浓盐酸中,生成的Cl2在标准状况下的体积为1.12 L。试计算(反应前后溶液的体积变化忽略不计):
金属氯化物+水+氯气的原理制取少量Cl2。现将一定质量的NaClO放入100 mL 10.00 mol·L-1的浓盐酸中,生成的Cl2在标准状况下的体积为1.12 L。试计算(反应前后溶液的体积变化忽略不计):
(1)反应过程中,被氧化的HCl的物质的量为____mol。
(2)反应后溶液中HCl的物质的量浓度为____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I的形式存在,几种粒子之间的转化关系如图所示。已知淀粉遇单质碘变蓝,下列说法中正确的是
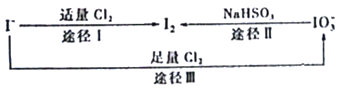
A. 向含I的溶液中通入Cl2,所得溶液加入淀粉溶液一定变蓝
B. 途径II中若生成1 mol I2,消耗1 mol NaHSO3
C. 氧化性的强弱顺序为Cl2>I2>IO3
D. 一定条件下,I与IO3可能生成I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________。
(4)计算H2C2O4溶液的物质的量浓度为__________mol/L。
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1molL-1KMnO4溶液 | 0.11molL-1H2C2O4溶液 | 0.11molL-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中v1=______。
(6)实验中需要测量的数据是______________________________。
(7)实验中______(填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上都有重要用途。
(1)基态钛原子外围电子的轨道表达式为_____。与钛同周期的元素中,基态原子的未成对电子数与钛原子相同的有_____种。
(2)TiCl4是氯化法制取钛的中间产物。TiCl4和SiC14在常温下都是液体,分子结构相同。采用蒸馏的方法分离TiCl4和SiCl4的混合物,先获得的馏分是_____(填化学式)。
(3)[Cr(C2O4)2(H2O2)]也是铬的一种化合物,该化合物属于离子化合物,其中除含离子键、共价键外,还含有_____键。
(4)雷氐盐(Reinecke salt)的化学式为NH4[Cr(NCS)4(NH3)2] H2O,是一种易溶于水和乙醇的暗红色固体。
①雷氏盐中铬元素的化合价为_____。
②NCS的立体构型是_____,其中碳原子的杂化轨道类型为_____。
③SO2、CO2、BeCl2、SCl2四种分子中,与NCS-互为等电子体的有_____(填化学式)。
(5)Ni和La的合金是目前使用广泛的储氢材料,具有容量大、寿命长、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
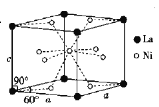
①晶体的化学式为_____。
②该晶胞的密度为dgcm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是____(用含d、NA的代数式表示)cm3。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子时比较稳定。已知: a=511pm,c=397pm;标准状况下,氢气的密度为8.98X10-5 g, ![]() ,若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_____(保留整数)。
,若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_____(保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
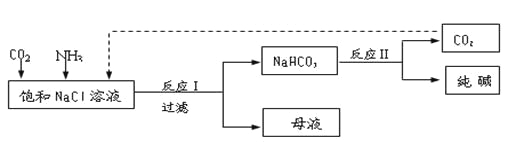
已知NaHCO3在低温下溶解度较小。
反应Ⅰ:NaCl+CO2+NH3+H2O![]() NaHCO3↓+NH4Cl,处理母液的两种方法:
NaHCO3↓+NH4Cl,处理母液的两种方法:
(1)向母液中加入石灰乳,可将其中________循环利用。
(2)向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式 ___________。
Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。

(1)装置丙中冷水的作用是_________;
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有_______、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为______;
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究。
取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。
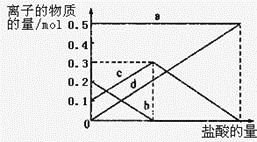
则曲线a对应的溶液中的离子是___________(填离子符号下同);曲线c对应的溶液中的离子是___________;该样品中NaHCO3和Na2CO3的物质的量之比是___________; 21
(4)若取21.0 g NaHCO3固体,加热了t2rnin后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 molL—1的盐酸中,则充分反应后溶液中H+ 的物质的量浓度为____________(设溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的单质及其化合物是常见的物质。完成下列填空:
已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:C(石墨)+O2(g)→CO2(g)+393.51kJ;C(金刚石)+O2(g)→CO2(g)+395.41kJ
(1)等质量时石墨的能量比金刚石的___(选填“高”或“低”),由石墨制备金刚石是___反应(选填“吸热”或“放热”)。
由焦炭与石英在高温的氮气流中反应,可制得一种新型陶瓷材料——氮化硅(Si3N4):C+SiO2+N2→Si3N4+CO(未配平)
(2)配平后的化学方程式各物质的化学计量数依次是___。若已知CO生成速率为v(CO)=12mol/(L·min),则N2消耗速率为v(N2)=___mol/(L·min)。
一定温度下10L密闭容器中发生某可逆反应,其平衡常数表达式为:K=![]() 。
。
(3)该反应的化学方程式为___。
(4)能判断该反应一定达到平衡状态的是___。
a.v正(H2O)=v逆(CO)
b.容器中气体的相对分子质量不随时间改变
c.消耗nmolH2同时消耗nmolCO
d.容器中物质的总物质的量不随时间改变
(5)已知常温下0.1mol/L碳酸氢钠溶液的pH=8.4,该溶液中的c(H2CO3)___c(CO32-)(选填“>”、“=”或“<”);该溶液电中性的表达式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有![]()
B.某溶液中加![]() 溶液生成白色沉淀,说明原溶液中有
溶液生成白色沉淀,说明原溶液中有![]()
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有![]()
D.某溶液中加稀硫酸溶液生成无色无味气体,说明原溶液中有![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com