
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:

请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为__________________________________。
(2)流程乙加入烧碱后生成[Al(OH)4]-的离子方程式为___________________________。
(3)验证滤液B中含Fe3+,可取少量滤液并加入________(填试剂名称)。
(4)滤液E、K中溶质的主要成分是__________(填化学式),写出该溶液的一种用途:___________。
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=__________。
【答案】Al2O3+6H+===2Al3++3H2OAl2O3+2OH-+3H2O ===2[Al(OH)4]-硫氰化钾(或苯酚溶液等合理答案均可)NaHCO3制纯碱(或做发酵粉等合理答案均可)5.6×10-10 mol·L-1
【解析】
(1)Al2O3与稀盐酸反应的离子方程式为:Al2O3+6H+= 2Al3++3H2O;
(2)Al2O3与烧碱反应的离子方程式为:Al2O3+2OH-+3H2O = 2[Al(OH)4]-;
(3)检验Fe3+通常用硫氰化钾(或硫氰酸钾),观察颜色变化,若溶液变为血红色,则证明有Fe3+;
(4)滤液Y和D为偏铝酸钠溶液,通入过量的二氧化碳反应的化学方程式为:NaAlO2+CO2+H2O=Al(OH)![]() + NaHCO3 ,因此滤液E、K中溶质的主要成分是NaHCO3。NaHCO3可用来制作纯碱,发酵粉等。
+ NaHCO3 ,因此滤液E、K中溶质的主要成分是NaHCO3。NaHCO3可用来制作纯碱,发酵粉等。
(4)根据题意:298 K时,测得pH=13.00,则c(OH-)=![]() ,因为Mg(OH)2的溶度积常数Ksp=5.6×10-12则:0.12×c(Mg2+)=5.6×10-12,解得c(Mg2+)=5.6×10-12mol/L。
,因为Mg(OH)2的溶度积常数Ksp=5.6×10-12则:0.12×c(Mg2+)=5.6×10-12,解得c(Mg2+)=5.6×10-12mol/L。


科目:高中化学 来源: 题型:
【题目】某固体混合物是由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3、KCl中的两种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积)。
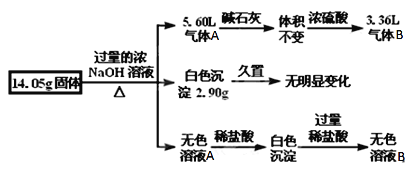
(1)气体B的成分是_________,由气体B的成分推测一定含有的物质的质量为________g。
(2)该固体混合物中_____(填“有”、“没有”或“不能确定”)KCl,理由是__________________,请另设计一种简单的方法检验该固体中是否含有KCl________________________________。
(3)另取14.05g固体混合物溶于1L 0.4mol/LNaHSO4溶液中,所得溶液中阴离子物质的量浓度之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构如右图所示,具有生物活性,如抗氧化和自由基清除能力等,可防止机体内脂质氧化和自由基的产生而引发的肿瘤等多种疾病。有关原花青素的下列说法不正确的是( )

A. 该物质既可看做醇类,也可看做酚类
B. 1 mol该物质可与4 mol Br2反应
C. 1 mol该物质可与7 mol NaOH反应
D. 1 mol该物质可与7 mol Na反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列六种基团:①苯基 ②醛基 ③羟基 ④羧基 ⑤乙基 ⑥氯原子(-Cl)这六种基团两两结合,可形成新的化合物,写出符合下列条件的化合物的结构简式。
(1)分子内氧原子数不超过2个,具有酸性,但不能和碳酸氢钠反应________________。
(2)分子内氧原子数不超过2个,能发生银镜反应的物质,除苯甲醛和甲酰氯(Cl-CHO)外还有______________、 ____________。
(3)不稳定的两元弱酸__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式_______,B的结构简式_____________________。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:___________________。
(3)在碘水中加入B振荡静置后的现象________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:_____________________________,反应类型:________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量________(填A>B、A<B或A=B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:

回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式________________。
为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有_____________(写出两条)。
(2) “浸渣”中除含有某种有磁性的物质外,还含有的物质是_____(写化学式)。
(3)“净化除杂”需先加H2O2溶液,作用是__________。然后再调节溶液的pH约为5,目的是______________。
(4)“粗硼酸”中的主要杂质是________(填名称)。
(5)单质硼可用于生产具有优良抗冲击性能的硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程_____________、 _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)![]() MgO(s)+CO2(g)+SO2(g)ΔH>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+CO2(g)+SO2(g)ΔH>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
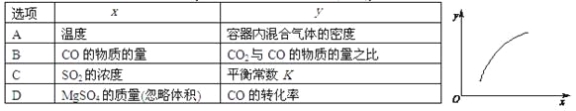
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学按照下面的实验方法制备氢氧化铁胶体:首先取少量蒸馏水于洁净的烧杯中,用酒精灯加热至沸腾,向烧杯中逐滴滴加饱和的FeCl3溶液继续煮沸,至液体呈透明的红褐色。反应原理为FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl。
Fe(OH)3(胶体)+3HCl。
(1)判断胶体制备是否成功,可利用胶体的________。
(2)在做制备氢氧化铁胶体的实验时,有些同学没有按要求进行,结果没有观察到胶体,请你预测其现象并分析原因:
①甲同学没有选用饱和氯化铁溶液,而是将稀氯化铁溶液滴入沸水中,结果没有观察到_________________________________,其原因是_________________________________________。
②乙同学在实验中没有使用蒸馏水,而是用自来水,结果会________,原因是____________________________________________________________________。
③丙同学向沸水中滴加饱和氯化铁溶液后,长时间加热,结果会________,原因是_____________________________________________________________________。
(3)丁同学按要求制备了Fe(OH)3胶体,但是他又向Fe(OH)3胶体中逐滴加入了稀H2SO4溶液,结果出现了一系列变化。
①先出现红褐色沉淀,原因是_________________________________________。
②随后沉淀溶解,此反应的离子方程式是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____。
(4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取2 mL 此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是____(填离子符号);实验①和③说明:在I-过量的情况下,
溶液中仍含有___(填离子符号),由此可以证明该氧化还原反应为________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是_______________;生成沉淀的原因是__________________(用平衡移动原理解释)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com