
| A、0.6mol |
| B、0.9mol |
| C、1.2mol |
| D、1.5mol |


科目:高中化学 来源: 题型:
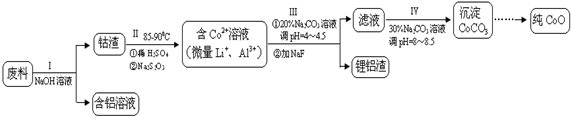
查看答案和解析>>
科目:高中化学 来源: 题型:
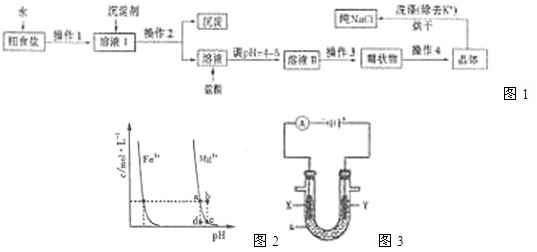
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、预制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
| B、用碘的水溶液鉴别乙醇、四氯化碳 |
| C、欲配制质量分数为10%的CuSO4溶液,将10gCuSO4?5H2O溶解在90g水中 |
| D、某同学用托盘天平称量5.85gNaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
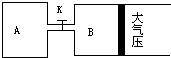
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等体积的盐酸和氨水的混合液 |
| B、水电离出的c(OH-)=1×10-3mol?L-1的溶液 |
| C、80℃时的氯化钠溶液 |
| D、c(H+)=1×10-3mol?L-1的酸雨c(OH-)=1×10-3mol?L-1的碱等体积混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
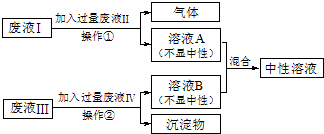
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量 | 0.390g | 0.702g | 0.936g |
| 标况下气体体积 | 448mL | 672mL | 672mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50 mL 0.5 mol/L的AlCl3溶液 |
| B、100 mL 2 mol/L的NaCl溶液 |
| C、1 L 0.2 mol/L的KCl溶液 |
| D、20 mL 0.5 mol/L的CaCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com