
(14分)Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下: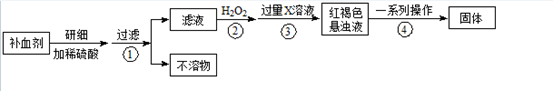
请回答下列问题:
(1)步骤②加入过量H2O2的目的: ;
(2)步骤③中反应的离子方程式: ;
(3)步骤④中一系列处理的操作步骤: 、洗涤、 、冷却、称量。
(4)实验中用浓硫酸配制1 mol/L的稀硫酸,配制时用到定量的玻璃仪器有 、
(答出两个仪器)。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
(14分)(1)将Fe2+全部氧化为Fe3+ (2分)
(2)Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+ (2分)
(3)过滤 (2分) 灼烧 (2分)
(4)容量瓶(2分) 量筒 (2分)
(5)0.07a (2分)
解析试题分析:(1)双氧水具有氧化性,能将Fe2+全部氧化为Fe3+,故答案为:将Fe2+全部氧化为Fe3+;(2)三价铁和碱反应生成氢氧化铁红褐色沉淀,所以加入的X为碱,故答案为:Fe3++3OH-=Fe(OH)3↓(或Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+);(3)从悬浊液中将沉淀物分离出来要先过滤,然后对固体洗涤,至洗涤干净后再灼烧分解,待冷却后称量,故答案为:过滤;冷却;(4)根据配制一定物质的量浓度的溶液所需要的仪器有:250mL容量瓶、天平、玻棒、烧杯、量筒、药匙、胶头滴管,故答案为:250mL容量瓶;
考点:铁及其化合物的相关性质
点评:本题是一道考查金属铁的化合物性质的综合性知识题目,要求学生具有分析和解决问题的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
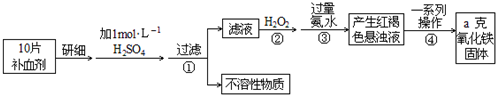
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。
⑴ 正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含 mg FeSO4·7H2O的片剂。
⑵ “速力菲”是市场上一种常见的补铁药物,其中Fe2+的含量为35.0%。该药品中Fe2+会缓慢氧化。国家规定该药物中Fe2+的氧化率超过10%即不能再服用。为检验某药店出售的“速力菲”是否失效,取10.00g该药品全部溶于稀硫酸,配制成1000mL溶液。取其中20.00mL,用0.01000 mol/L KMnO4溶液滴定,用去KMnO4溶液24.00mL。通过计算说明该药物是否能服用?(MnO4-在酸性条件下的还原产物为Mn2+,药品中除Fe元素外其他成分不与KMnO4反应)
查看答案和解析>>
科目:高中化学 来源:2010年广东省龙川一中高三8月月考(理综)化学部分 题型:填空题
(15分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含 mg FeSO4·7H2O的片剂。
(2)某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在一支试管中滴入酸性高锰酸钾溶液,在另一支试管中滴入KSCN溶液。该同学观察到的现象是:滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液后不变红,据此得出的结论是 。
(3)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2 6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移 mol电子。
6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移 mol电子。
(4)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;
(5)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是 。
查看答案和解析>>
科目:高中化学 来源:岳阳市2010届高三第四次质检考试(化学)试题 题型:计算题
(8分) Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。
⑴ 正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含 mg FeSO4·7H2O的片剂。
⑵ “速力菲”是市场上一种常见的补铁药物,其中Fe2+的含量为35.0%。该药品中Fe2+会缓慢氧化。国家规定该药物中Fe2+的氧化率超过10%即不能再服用。为检验某药店出售的“速力菲”是否失效,取10.00g该药品全部溶于稀硫酸,配制成1000mL溶液。取其中20.00mL,用0.01000 mol/L KMnO4溶液滴定,用去KMnO4溶液24.00mL。通过计算说明该药物是否能服用?(MnO4-在酸性条件下的还原产物为Mn2+,药品中除Fe元素外其他成分不与KMnO4反应)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com