
对下列过程中熵变的判断不正确的是( )
|
| A. | 溶解少量食盐于水中:△S>0 |
|
| B. | H2O(g)变成液态水:△S>0 |
|
| C. | 纯碳和氧气反应生成CO(g):△S>0 |
|
| D. | CaCO3(s)高温分解为CaO(s)和CO2(g):△S>0 |
考点:
焓变和熵变.
专题:
化学反应中的能量变化.
分析:
A.混乱度越大熵值越大;
B.同一物质三态中熵值大小关系为:气态>液态>固态;
C.依据碳与氧气反应生成一氧化碳方程式判断;
D.依据碳酸钙分解的化学方程式判断熵值的变化.
解答:
解:A.食盐的溶解过程,体现混乱度增大,所以熵值增加,△S>0,故A正确;
B.气态水变为液态,熵值减小,△S<0,故B错误;
C.纯碳和氧气反应生成CO(g)方程式为:C(s)+O2(g) 2CO(g),该反应是气体体积增大的反应,熵值增大,故△S>0,故C正确;
2CO(g),该反应是气体体积增大的反应,熵值增大,故△S>0,故C正确;
D.CaCO3(s)高温分解为CaO(s)和CO2(g),方程式为:CaCO3(s) CaO(s)+CO2(g),反应生成气体,是熵值增加的过程,故△S>0,故D正确;
CaO(s)+CO2(g),反应生成气体,是熵值增加的过程,故△S>0,故D正确;
故选:B.
点评:
本题考查了变化过程中熵变化的分析判断,题目难度中等,判断时把握住熵的含义﹣描述的是体系的混乱度,混乱度越大熵值越大,注意积累常见的熵增加的过程,例如:物质由固﹣液﹣气;反应中有气体生成或者气体体积增大的反应;溶质的溶解;气体的扩散等都属于熵值增加的过程.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
a g Cu与含b g HNO3的溶液恰好反应,若a∶b=8∶21,则反应中被还原硝酸的质量为 ( )
A.b g B.b/2 g C.3b/4 g D.b/4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸铜水溶液呈酸性,属保护性无机杀菌剂,对人畜比较安全,其与石灰乳混合可得“波尔多液”。实验室里需用480 mL 0.10 mol·L-1的硫酸铜溶液,则应选用的容量瓶规格和称取溶质的质量分别为 ( )
A.480 mL容量瓶,称取7.68 g硫酸铜
B.480 mL容量瓶,称取12.0 g胆矾
C.500 mL容量瓶,称取8.00 g硫酸铜
D.500 mL容量瓶,称取12.5 g胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.195 g锌粉加入到20.0 mL的0.100 mol·L-1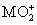 溶液中,恰好完全反应,则还原产物可能是( )
溶液中,恰好完全反应,则还原产物可能是( )
A.M B.M2+ C.M3+ D. MO2+
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=﹣870.3kJ•mol﹣1
(2)C(s)+O2(g)=CO2(g)△H2=﹣393.5kJ•mol﹣1
(3)H2(g)+ O2(g)=H2O(l)△H3=﹣285.8kJ•mol﹣1
O2(g)=H2O(l)△H3=﹣285.8kJ•mol﹣1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的△H为( )kJ•mol﹣1.
|
| A. | +488.3 | B. | ﹣244.15 | C. | ﹣488.3 | D. | +244.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有一处于平衡状态的可逆反应:X(s)+3Y(g)⇌2Z(g)(△H<0).为了使平衡向生成Z的方向移动,应选择的条件是( )
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z.
|
| A. | ①③⑤ | B. | ②③⑤ | C. | ②③⑥ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有反应:mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为 热反应,且m+n p(填“>”“=”“<”).
(2)减压时,A的质量分数 .(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率 ,B的转化率 .
(4)若升高温度,则平衡时B、C的浓度之比将 .
(5)若加入催化剂,平衡时气体混合物的总物质的量 .
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色 ,而维持容器内压强不变,充入氖气时,混合物颜色 (填“变深”“变浅”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
不能用有关胶体的观点解释的现象是( )
|
| A. | 在河流人海口处易形成三角洲 |
|
| B. | 在NaHCO3溶液中滴入CaCl2溶液,看不到沉淀 |
|
| C. | 少许FeCl3饱和溶液逐滴滴入沸水中,看不到红褐色沉淀 |
|
| D. | 同一支钢笔,同时使用不同牌号的墨水易发生堵塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为测定镁铝合金(不含其它元素)中铝的质量分数,甲乙两个学习小组设计了下列二种不同的实验方案进行探究.请回答下列问题:
(一)甲组:实验方案:镁铝合金 测定剩余固体质量
测定剩余固体质量
实验步骤:
①称量:托盘天平称量2.7g镁铝合金粉末
②溶解:将①中药品加入烧杯中,用量筒量取至少 mL 1mol/L NaOH 溶液加入烧杯中,不断搅拌,充分反应
③过滤:
④洗涤:若未对过滤所得固体进行洗涤,测得铝的质量分数将 (填“偏高”、“偏低”或“不变”),证明固体已洗涤干净的方法为
⑤干燥、称量剩余固体
(二)乙组:
实验方案:
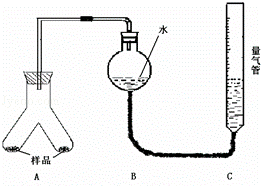
实验装置如图,实验步骤如下:
①按图连接好装置
②称取两份质量均为0.3g 的镁铝合金样品粉末,分别放入A装置左右两个管中,向B装置中加入一定量的水,把装置A.B的胶塞塞好,然后调节C的高度使B和C中的液面相平,记录下此时的体积为112mL
③通过注射器的针头向装置A左侧管中注入足量的稀盐酸,等不再有气泡产生时,调节装置C的高度,使B和C中的液面相平时记录下此时的体积为448mL
④通过另一针头向装置A右侧管中加入足量的稀NaOH溶液,等不再有气泡产生时,调节装置C的高度,使B和C中的液面相平时记录下此时的体积为672mL.
问题和讨论:
(1)上述实验步骤①和②之间必须加一步检查气密性的操作,具体方法为
(2)为使气体体积测定结果不至于引起很大偏差,除了应注意使B和C中的液面相平外,在反应完全后至读数之前,还需要注意的关键问题是(有几点写几点) .
(3)计算合金中铝的质量分数时,是否需要将气体体积折算为标准状况的体积否,试根据题中数据计算出合金中铝的质量分数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com