
【题目】海洋占据地球面积的![]() ,拥有丰富的资源,从海洋中可以提取钠、镁、溴、碘等物质。提取溴的过程有一步反应的离子方程式:
,拥有丰富的资源,从海洋中可以提取钠、镁、溴、碘等物质。提取溴的过程有一步反应的离子方程式:![]() 。下列叙述错误的是
。下列叙述错误的是
A.![]() 为还原剂B.
为还原剂B.![]() 既不是氧化剂,又不是还原剂
既不是氧化剂,又不是还原剂
C.生成![]() ,转移
,转移![]() 电子D.
电子D.![]() 仅为氧化产物
仅为氧化产物
【答案】D
【解析】
由反应的化学方程式可知,反应中,溴离子中的溴元素化合价升高被氧化,溴离子为反应的还原剂,溴酸根中溴元素的化合价降低被还原,溴酸根为反应的氧化剂,溴单质即是氧化产物,也是还原产物。
A.由分析可知,反应中,溴离子中的溴元素化合价升高被氧化,溴离子为反应的还原剂,故A正确;
B.由反应的化学方程式可知,反应中,氢元素的化合价没有变化,则氢离子既不是氧化剂,又不是还原剂,故B正确;
C.由反应的化学方程式可知,反应中,生成3mol溴,反应转移5mol单质,故C正确;
D.由分析可知,反应中,溴离子中的溴元素化合价升高被氧化,溴酸根中溴元素的化合价降低被还原,溴单质即是氧化产物,也是还原产物,故D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】黑火药爆炸时发生化学反应:S+2KNO3+3C→K2S+3CO2↑+N2↑,完成下列填空:
(1)上述反应涉及的元素中,非金属性最强的是___,试写出属于第二周期的元素的原子半径大小有___>___>___。(填元素符号)
(2)上述反应的生成物中,属于离子化合物的是___,其电子式为___。
(3)硫元素的气态氢化物所含化学键类型为___(填“离子键”或“共价键”),其水溶液长期遭空气中放置容易变浑浊,用化学方程式表示该变化___,该变化体现出硫元素的非金属性比氧元素___(填“强”或“弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用燃烧法分析有机物的组成与结构。某化合物样品在足量O2中充分燃烧,生成物只有CO2和H2O。燃烧产物依次经过浓硫酸和碱石灰充分吸收,浓硫酸和碱石灰依次增重7.2g和17.6g。有关该物质的组成和结构推测不合理的是( )
A.该物质可能是烃类化合物
B.该物质结构中可能含C=C
C.该物质结构中可能含苯环
D.该物质结构中可能含羧基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是

A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.点③所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有关物质的溶度积如下
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
下列有关说法不正确的是( )
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
C.向含有Mg 2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg 2+)∶c(Fe3+)=2 .125×1021
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和[c(Ca2+)=1.054×10-2mol/L],若保持温度不变, 向其中加入100mL 0.012mol/L的NaOH,则该溶液变为不饱和溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g) + 3H2(g) ![]() 2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。请回答下列问题:
2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示。请回答下列问题:

(1)上图中属于氢气物质的量随时间变化的曲线是_____________(填“I”、“II”或“Ⅲ”)。
(2)关于t2时刻的说法正确的是______。
A.t2时该反应达到平衡状态 b.t2时II和III代表的物质反应速率相同
c.t2时氢气、氮气与氨气的反应速率之比为3:1:2 D.t2时氨气与氢气的物质的量相同
(3)对于II所代表的物质,其逆反应速率最大的点是__________(填“c”、“d”或“g”);对于I所代表的物质,其正反应速率最小的点是___________ (填“a”、“e”或“f”)。
(4)其他条件不变,只改变温度,在改变的这个温度下反应至t3时刻,此时n(H2)比图象中的值大,那么该温度可能是____________(填序号)。
A.673 K B.273 K C.373 K
(5)在密闭容器中充入2 mol N2和6 mol H2,—定条件下建立平衡:N2(g) + 3H2(g) ![]() 2NH3(g) △H=-92.2kJ/mol,测得 N2 的转化率为 90%,则在此条件下,反应放出的热量为___________kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应_________(填“放出”或“吸收”)的热量为___________kJ。
2NH3(g) △H=-92.2kJ/mol,测得 N2 的转化率为 90%,则在此条件下,反应放出的热量为___________kJ。若与上述反应的温度和体积相同时,向密闭容器中充入4 mol NH3,则达平衡后,反应_________(填“放出”或“吸收”)的热量为___________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”——全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法不正确的是
A.分子中三个碳原子不可能处于同一直线上
B.相同压强下,沸点:C3F8>C3H8
C.全氟丙烷的电子式为: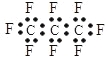
D.全氟丙烷分子中既有极性键又有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在溶液中大量共存的一组是( )
A.K+、NH![]() 、CO
、CO![]() 、OH-B.Cu2+、Na+、NO
、OH-B.Cu2+、Na+、NO![]() 、Cl-
、Cl-
C.Na+、Ba2+、SO![]() 、I-D.H+、Fe2+、NO
、I-D.H+、Fe2+、NO![]() 、ClO-
、ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,雾霾天气成为我国华北地区乃至全国的环境问题之一。
Ⅰ汽车尾气是空气污染的重要原因。汽车尾气净化原理为:
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H <0。
2CO2(g)+N2(g) △H <0。
(1)该反应的平衡常数表达式为____________________。
(2)在一恒容的绝热容器(不与外界发生热交换)中模拟上述反应。下面各示意图正确且能说明反应在t1时刻达到平衡状态的是__________。
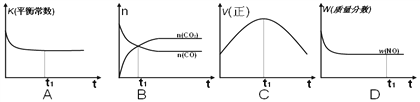
Ⅱ煤燃烧产生的烟气中含有大量硫、氮的氧化物,会引起严重的环境污染问题。
(1) 硫、氮的氧化物都会形成酸雨。为减少酸雨产生,下列措施中不可行的有_______(填序号)。
a.少用煤作燃料 b.把工厂的烟囱加高 c.燃料脱硫
d.燃煤时鼓入足量空气 e.开发新能源
(2)煤燃烧产生的氮的氧化物可以用CH4催化还原。已知:
CH4(g) + 2NO2(g) = N2(g) +CO2(g) + 2H2O(g) △H =-867kJ/mol
2NO2(g) = N2O4(g) △H =-56.9kJ/mol
H2O(l) = H2O(g) △H =+44kJ/mol
写出CH4(g) 还原N2O4(g)生成N2(g) 、CO2(g)和H2O(l)的热化学方程式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com