
【题目】甲基丙烯酸甲酯是合成有机玻璃的单体,其合成方法之一如下:CH3OC≡CH+CH3OH+A ![]() CH2=C(CH3)COOCH3,下列说法正确的是
CH2=C(CH3)COOCH3,下列说法正确的是
A. 已知该反应的原子利用率为100%,则A为CO2
B. CH3OH和甘油互为同系物
C. CH3C≡CH与丙烯的性质相似,则该物质可以发生加成、氧化反应
D. 能与NaHCO3反应的CH2=C(CH3)COOCH3的同分异构体有9种
【答案】C
【解析】
A. 已知该反应的原子利用率为100%,则产物只有CH2=C(CH3)COOCH3,根据质量守恒定律可以判断A不可能是CO2,A不正确;B. CH3OH和甘油两者所含的官能团的数目不同,所以不是同系物,B不正确;C. CH3C≡CH与丙烯的性质相似,因为丙烯能发生加成反应和氧化反应,所以该物质可以发生加成、氧化反应,C正确;D. 能与NaHCO3反应的CH2=C(CH3)COOCH3的同分异构体属于羧酸,分子中除—COOH外,还有—C4H7。—C4H7可能是丁烯基,丁烯基有8种结构;还有可能是环丁基和甲基环丙烷基(有3种结构),所以该同分异构体有12种,D不正确。本题选C。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】新型纤维酸类降脂药克利贝特可由物质X在一定条件下反应制得:
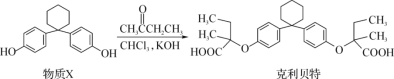
下列有关叙述正确的是
A. 物质X分子中所有碳原子不可能位于同一平面内
B. 1mol物质X最多可以与含2 mol Br2的溴水反应
C. 克利贝特分子中含有三个手性碳原子
D. 用饱和NaHCO3溶液可以鉴别物质X和克利贝特
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水约占地球表面积的71%,具有十分巨大的开发潜力。下图是开水资源综合利用的工艺图,以下说法正确( )

A. 电解NaCl溶液时可用铁做电极,其离子方程式为:2Cl- + 2H2O = 2OH-+ H2↑+ Cl2↑
B. 向苦卤中加入Cl2的作用是置换出溴单质,该过程体现了还原性:Cl- > Br-
C. 实验室模拟海水提取淡水,除夹持装置外只用到的仪器有蒸馏烧瓶、酒精灯、锥形瓶
D. Br2 与SO2的水溶液发生反应的离子方程式为:Br2 + SO2 + 2H2O =4H+ + 2Br- + SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铋酸钠(NaBiNO3)检验溶液中的Mn2+,反应方程式为:4MnSO4+10NaBiO3+14H2SO4═4NaMnO4+5Bi2(SO4)3+3Na2SO4+口,下列说法不正确的是
A. 口内的物质为水,配平系数为14。
B. 若生成1mol NaMnO4,则转移5mole-
C. 反应方程式中的硫酸可换为盐酸
D. 溶液中有Mn2+的现象是溶液变为紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应实际上包含氧化和还原两个过程.下面是一个还原过程的反应式:NO3-+4H++3e-═NO↑+2H2O,KMnO4、Na2CO3、Cu2O、FeSO4四种物质中有物质(甲)能使上述还原过程发生。则下列说法中正确的是( )
A.物质甲可能是KMnO4
B.反应中只体现了硝酸的强氧化性
C.氧化过程的反应式一定为Cu2O-2e-+2H+═2Cu2++H2O
D.反应中若产生3.0 g气体,则转移电子数约为0.3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
(1)写出这四种元素的元素符号:T_______;X_______;Y_______;Z_______。
(2)写出元素T的原子结构示意图_____________________________
(3)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是__________(填序号)。
①Y单质的熔点比Z单质低 ②Y的化合价比Z低
③Y单质与水反应比Z单质剧烈 ④Y最高价氧化物的水化物的碱性比Z强
(4)X元素的气态氢化物与其最高价含氧酸反应的方程式为______________________
(5)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素以原子个数比1∶2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某体积固定的密闭容器中加入2 mol A和1 mol B,发生可逆反应![]() ,下列说法正确的是
,下列说法正确的是
A. 当容器内压强不变时说明反应已达到平衡
B. 当反应达到平衡时:c(A):c(B):c(C)=2:1:3
C. 当反应达到平衡时放出热量akJ
D. 其他条件不变,升高温度反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,其制备原理为:![]()
甲、乙两同学分别设计了如下装置来制备乙酸乙酯。

请回答下列问题:
(1)下列说法不正确的是________。
A.加入试剂的顺序依次为乙醇、浓硫酸、乙酸
B.饱和碳酸钠的作用是中和乙酸、溶解乙醇、促进乙酸乙酯在水中的溶解
C.浓硫酸在反应中作催化剂和吸水剂,加入的量越多对反应越有利
D.反应结束后,将试管中收集到的产品倒入分液漏斗中,振荡、静置,待液体分层后即可从上口倒出上层的乙酸乙酯
(2)乙装置优于甲装置的理由是________。(至少说出两点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3 mol A气体和1 mol B气体混合于固定容积为2 L的密闭容器中,发生反应:3A(g)+B(g) ![]() C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
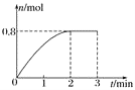
A. 若混合气体的密度不再改变时,该反应不一定达到平衡状态
B. 2 min后,加压会使正反应速率加快,逆反应速率变慢
C. 反应过程中A和B的转化率之比为3∶1
D. 开始到平衡,用A表示的化学反应速率为0.3 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com