
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ③④ |
分析 影响化学反应速率的因素有温度、浓度、压强、催化剂、x射线、固体物质的表面积等.浓度:增加反应物浓度,使反应速率加快.温度:升高温度,使反应速率加快.压强:对于有气体参与的化学反应,除体积其它条件不变时,增大压强,使反应速率加快.使用正催化剂,使反应物速率加快.
解答 解:用3克块状大理石与30毫升3摩/升盐酸反应制取CO2气体发生的反应为:CaCO3+2HCl═CaCl2+CO2↑+H2O 要增大反应速率,则:
①再加入30毫升3摩/升盐酸,盐酸浓度未变,反应速率不变,故①错误;
②改用30毫升3摩/升硫酸.硫酸与碳酸钙反应生成的硫酸钙微溶于水,附着在碳酸钙表面,减小了硫酸与碳酸钙的接触面积,反应速率减慢.故②错误;
③改用3克粉末状大理石,大理石与盐酸的接触面积增大,反应速率加快.故③正确;
④适当升高温度.升高温度,反应物分子获得能量,使一部分原来能量较低分子变成活化分子,增加了活化分子的百分数,使得有效碰撞次数增多,故反应速率加大.故④正确;
故选D.
点评 本题考查了影响化学反应速率的因素,掌握影响化学反应速率的因素有哪些,为什么能够影响,是解题的关键,平时学习需理解记忆.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
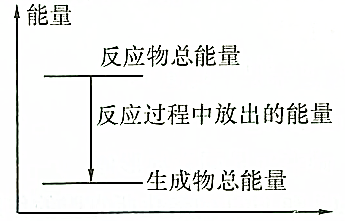
| A. | 反应过程中的能量关系可用如图表示 | |
| B. | 1mol锌所含的能量高于1mol H2 所含的能量 | |
| C. | 若将其设计为原电池,则锌为正极 | |
| D. | 若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将机动车尾气排放标准从国家Ⅱ号标准提高到国家Ⅲ号标准 | |
| B. | 采用强氧化剂将SO2氧化为SO3再排放到大气中 | |
| C. | 采用原煤脱硫技术,降低燃煤中硫的含量 | |
| D. | 向燃煤中加入适量石灰石,减少燃烧产物中SO2的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙烯制溴乙烷:CH2CH2+Br2→CH2BrCH2Br | |
| B. | 乙醇催化氧化:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3COH+2H2O | |
| C. | 苯与氢气加成: +3H2$\stackrel{Ni}{→}$ +3H2$\stackrel{Ni}{→}$ (环己烷) (环己烷) | |
| D. | 从海带中提取碘:H2O2+2I-+2H+=I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
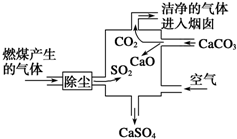
| A. | 进入烟囱的气体为混合物 | |
| B. | 此过程中硫元素的化合价没有发生改变 | |
| C. | 使用此废气处理装置可减少酸雨的形成 | |
| D. | 整个过程的反应可表示为2SO2+2CaCO3+O2═2CaSO4+2CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 条件 | 结论 |
| A | 若X原子半径X>Y | 原子序数:X<Y |
| B | 若最高价氧化物对应水化物酸性X>Y | 元素的电负性:X>Y |
| C | 若价电子数X>Y | 最高正价:X>Y |
| D | 若X、Y最外层电子数分别为1、7 | X、Y之间一定能形成离子键 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 6:1 | B. | 2:1 | C. | 1:2 | D. | 9:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯化铜溶液中加入氢氧化铁 | B. | 硝酸铝溶液中加入氨水 | ||
| C. | 氢氧化钾溶液中加入硫化铜 | D. | 碳酸氨中加入氢氧化钾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com