


科目:高中化学 来源: 题型:
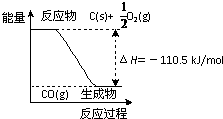 反应2C+O2=2CO 的能量变化如图所示.含11.2g KOH的稀溶液与1L0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列说法正确的是( )
反应2C+O2=2CO 的能量变化如图所示.含11.2g KOH的稀溶液与1L0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
含11.2g KOH的稀溶液与1L 0.1mol/L的H2SO4溶液反应放出11.4kJ的热量,下列能正确表示中和热的热化学方程式是
A.KOH(aq) + 1/2 H2SO4(aq) =1/2K2SO4(aq) + H2O (l);ΔH=-11.46kJ/mol
B.2KOH(s) + H2SO4(aq)= K2SO4(aq) + 2H2O (l);ΔH=-114.6kJ/mol
C.2KOH(aq) + H2SO4 =K2SO4(aq)+ H2O (l) ;ΔH=+114.6kJ/mol
D.KOH(aq) + 1/2 H2SO4(aq) = 1/2 K2SO4(aq)+ H2O (l) ;ΔH=-57.0kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014届吉林省高二上学期期末考试化学试卷(解析版) 题型:选择题
含11.2g KOH的稀溶液与1L、0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列能正确表示中和热的热化学方程式是( )
A、KOH(aq) + 1/2 H2SO4(aq) = 1/2K2SO4(aq) + H2O(l);ΔH =-11.46kJ/mol
B、2KOH(s) + H2SO4(aq) = K2SO4(aq) + 2H2O(l);ΔH =-114.6kJ/mol
C、2KOH(aq) + H2SO4 =K2SO4(aq) + H2O(l);ΔH =+114.6kJ/mol
D、KOH (aq) + 1/2 H2SO4(aq) = 1/2K2SO4(aq) + H2O(l);ΔH =-57.3kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com