
【题目】下表列出了周期表中前20号元素中的十种元素的相关数据:
元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
最高价态 | +1 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | — |
最低价态 | — | — | -2 | — | -4 | -3 | -1 | — | -3 | -1 |
试回答下列问题:
(1)以上10种元素的原子中,最容易失去电子的是________(填元素符号),与H2最容易化合的非金属单质是________(写物质名称)。
(2)若⑨形成的简单氢化物为A,⑥形成的简单氢化物为B,则二者的沸点A______B(填“大于”或“小于”)
(3)写出元素③形成的一种具有强氧化性的氢化物的电子式______________。
(4)写出上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式______________;⑤的最高价氧化物的结构式为__________。
(5)写出④的最高价氧化物的水化物与⑦的最高价氧化物的水化物反应的化学反应方程式:________________________________________________________。
【答案】 K 氟气 大于  CCl4或 PCl3 O=C=O Al(OH)3 + 3HClO4 = Al(ClO4 )3+ 3H2O
CCl4或 PCl3 O=C=O Al(OH)3 + 3HClO4 = Al(ClO4 )3+ 3H2O
【解析】主族元素中,元素的最高化合价数值与其族序数相等,最低化合价数值=8-其族序数,同一周期中,元素的原子半径随着原子序数增大而减小,同一主族中,元素的原子半径随着原子序数的增大而增大,①②⑧最高正价为+1,为第IA族元素,第IA族原子半径都大于⑩原子半径,结合原子半径可知,①是Li元素、②是K元素、⑧是Na元素;⑦⑩最低价为-1,为第VIIA族元素,⑦的原子半径大于⑩,所以⑦是Cl元素、⑩是F元素;③只有-2价,为第VIA族元素,则③是O元素;④只有+3价,为第IIIA族元素,原子半径大于Cl原子半径,所以④是Al元素;⑤有+4、-4价,为第IVA族元素,原子半径小于Cl原子半径,所以⑤是C元素;⑥⑨有+5、-3价,为第VA族元素,⑥的原子半径大于⑨,则⑥是P元素、⑨是N元素,则
(1)这几种元素中,金属性最强的是K,最易失去电子;与H2最容易化合的非金属是最活泼的非金属F,单质是氟气;(2)氨气分子间形成氢键,则氨气的沸点高于PH3的沸点;(3)元素③是O,形成的一种具有强氧化性的氢化物是双氧水,属于共价化合物,电子式为![]() 。(4)⑤是C元素、⑥是P元素、⑦是Cl元素,⑤、⑥、⑦三种元素中的两种元素形成的化合物有PCl3、CCl4、PCl5,元素化合价的绝对值+其最外层电子数=8,则该原子达到8电子稳定结构,所以每个原子都满足最外层为8电子稳定结构的物质的化学式为 PCl3、CCl4;⑤的最高价氧化物CO2的结构式为O=C=O;(5)④的最高价氧化物的水化物氢氧化铝与⑦的最高价氧化物的水化物高氯酸反应的化学反应方程式为Al(OH)3 + 3HClO4 = Al(ClO4 )3+ 3H2O。
。(4)⑤是C元素、⑥是P元素、⑦是Cl元素,⑤、⑥、⑦三种元素中的两种元素形成的化合物有PCl3、CCl4、PCl5,元素化合价的绝对值+其最外层电子数=8,则该原子达到8电子稳定结构,所以每个原子都满足最外层为8电子稳定结构的物质的化学式为 PCl3、CCl4;⑤的最高价氧化物CO2的结构式为O=C=O;(5)④的最高价氧化物的水化物氢氧化铝与⑦的最高价氧化物的水化物高氯酸反应的化学反应方程式为Al(OH)3 + 3HClO4 = Al(ClO4 )3+ 3H2O。


科目:高中化学 来源: 题型:
【题目】在密闭容器中一定量混合气体发生反应:xA(g)+yB(g) ![]() zC(g)平衡时测得A的浓度为0.5 mol·L-1,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为0.2 mol·L-1,下列判断正确的是( )
zC(g)平衡时测得A的浓度为0.5 mol·L-1,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为0.2 mol·L-1,下列判断正确的是( )
A. 平衡向正反应方向移动 B. x+y>z
C. C的体积分数保持不变 D. B的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中能说明某物质是弱电解质的是( )
A. 熔融状态下不导电
B. 不是离子化合物,而是共价化合物
C. 水溶液的导电能力很差
D. 溶液中溶质分子和电离出的离子共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):
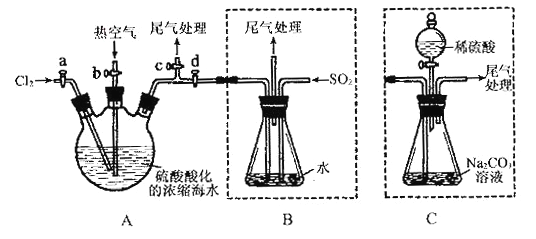
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入至反应结束;②关闭a、c,打开b、d,向A中鼓入足量热空气;③进行步骤②的同时,向B中通入足量SO2 ;④关闭b,打开a,再通过A向B中缓慢通入足量Cl2 ;
⑤将B中所得液体进行蒸馏,收集液溴。
请回答:(1)实验室中采用固液加热制备氯气的化学方程式为______________________;
(2)步骤②中鼓入热空气的作用为_________________________;
(3)步骤③B中发生的主要反应的离子方程式为_____________________。
(4)此实验中尾气可用______________(填选项字母)吸收处理。
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCl溶液
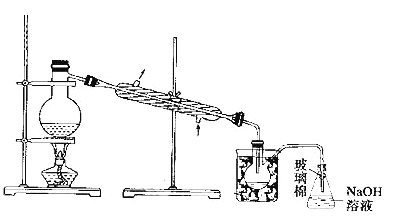
(5)步骤⑤中,用下图所示装置进行蒸馏,收集液溴,将装置图中缺少的必要仪器补画出来。
(6)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBrO3等,请写出滴加稀硫酸时发生反应的离子方程式_________________。
(7)与B装置相比,采用C装置的优点为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应在一定条件下达到化学平衡时,下列说法正确的是( )
A.正反应速率等于逆反应速率,且都为零
B.反应物和生成物浓度相等
C.反应体系中混合物的组成保持不变
D.断开化学键吸收的能量等于形成化学键所放出的能量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业合成氨的原理是N2(g)+3H2(g)=2NH3(g) △H=-93.0kJ/mol
(1)已知一定条件下:2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H=-+1530.0kJ/mol。则氢气燃烧热的热化学方程式为_________________。
(2)如下图,在恒温恒容装置中进行合成氨反应。

①表示N2浓度变化的曲线是_________。
②前25min内,用H2浓度变化表示的化学反应速率是_____________。
③在25min末刚好平衡,则平衡常数K=___________。
(3)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是_______________。
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩容器,生成更多NH3
(4)电厂烟气脱氮的主反应为:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H<0
副反应为:2NH3(g)+8NO(g)=5N2O(g)+3H2O(g) △H>0
平衡混合气中N2与N2O含量与温度的关系如下图所示。

请回答:在400~600K时,平衡混合气中N2含量随温度的变化规律是______,导致这种规律的原因是_________(任答合理的一条原因)。
(5)直接供氨式燃料电池是以NaOH溶液为电解质溶液,电池反应为4NH3+3O2=2N2+6H2O。则负极电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中,正确的是( )
A. 稀硫酸滴在银片上:2Ag+2H+=2Ag++H2↑
B. 氧化铁与稀盐酸混合:Fe2O3+6H+=2Fe3++3H2O
C. 碳酸钙溶于醋酸溶液中:CaCO3+2H+=Ca2++CO2↑+H2O
D. 饱和石灰水跟稀硝酸反应:Ca(OH) 2+2H+=Ca2++2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com