
����Ŀ��ij��ѧ�о���ѧϰС��Ϊ��ģ�ҵ���̴�Ũ���ĺ�ˮ����ȡҺ�壬��������֪��Br2�ķе�Ϊ59�棬����ˮ���ж��ԡ���������²������輰��Ҫʵ��װ��(�г�װ����ȥ)��
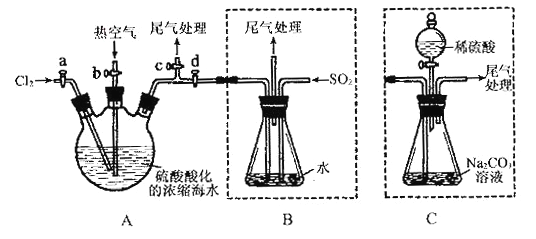
������A��B���رջ���b��d������a��c����A�л���ͨ������Ӧ�������ڹر�a��c����b��d����A�й��������ȿ������۽��в���ڵ�ͬʱ����B��ͨ������SO2 ���ܹر�b����a����ͨ��A��B�л���ͨ������Cl2 ;
�ݽ�B������Һ����������ռ�Һ�塣
��ش�(1)ʵ�����в��ù�Һ�����Ʊ������Ļ�ѧ����ʽΪ______________________��
(2)������й����ȿ���������Ϊ_________________________��
(3)�����B�з�������Ҫ��Ӧ�����ӷ���ʽΪ_____________________��
(4)��ʵ����β������______________(��ѡ����ĸ)���մ�����
a��ˮ b��Ũ���� c��NaOH��Һ d.����NaCl��Һ
(5)������У�����ͼ��ʾװ�ý��������ռ�Һ�壬��װ��ͼ��ȱ�ٵı�Ҫ��������������
(6)��ֱ������A��C�����в���ٺ͢ڣ���ַ�Ӧ������ƿ�еμ�ϡ���ᣬ�پ�����ݣ�Ҳ���Ƶ�Һ�塣�μ�ϡ����֮ǰ��C�з�Ӧ������NaBrO3�ȣ���д���μ�ϡ����ʱ������Ӧ�����ӷ���ʽ_________________��
(7)��Bװ����ȣ�����Cװ�õ��ŵ�Ϊ_____________________��
���𰸡� MnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O ʹA�����ɵ�Br2�����������B�� Br2��SO2��2H2O��4H+��2Br-��SO42-�� c
MnCl2+Cl2��+2H2O ʹA�����ɵ�Br2�����������B�� Br2��SO2��2H2O��4H+��2Br-��SO42-�� c  �٢۱ػ����ڲ���Ҫ��(��ˮ��ҺҺ�����ձ���Һ����Ը߶ȿɲ���Ҫ��) 5Br-��BrO3-��6H+=3Br2+3H2O(7)��������ȾС
�٢۱ػ����ڲ���Ҫ��(��ˮ��ҺҺ�����ձ���Һ����Ը߶ȿɲ���Ҫ��) 5Br-��BrO3-��6H+=3Br2+3H2O(7)��������ȾС
����������1���ȿ��������ǽ������������������й����ȿ���������ΪʹA�����ɵ�Br2 �����������B�У���2������������л�ԭ�ԣ��ܱ���������������з�������Ҫ��Ӧ�����ӷ���ʽΪBr2��SO2��2H2O��4H+��2Br����SO42-����3�������������������������������Һ���գ���ѡC����4���μ�ϡ����֮ǰ��C�з�Ӧ������NaBrO3�ȣ���˵�����̼������Һ����������ԭ��Ӧ����Ӧ�Ļ�ѧ����ʽΪ3Br2��3Na2CO3��5NaBr��NaBrO3��3CO2������5��β����ˮ����Ч�����˸���װ�ù����֪��Bװ����ȣ�����Cװ�õ��ŵ�Ϊ��������ȾС��


 ������������ϵ�д�
������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�������ܱ������н��з�Ӧ��2SO2(g)��O2(g)![]() 2SO3(g) ��H<0�����и�ͼ��ʾ��������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ����( )
2SO3(g) ��H<0�����и�ͼ��ʾ��������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ����( )

A��ͼ���ʾ�¶ȶԻ�ѧƽ���Ӱ�죬�Ҽ��¶Ƚϸ�
B��ͼ���ʾt0ʱ��ʹ�ô����Է�Ӧ���ʵ�Ӱ��
C��ͼ���ʾt0ʱ������O2��Ũ�ȶԷ�Ӧ���ʵ�Ӱ��
D��ͼ����a��b��c������ֻ��b���Ѿ��ﵽ��ѧƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�к��е��Ȼ�þ��þ����Ҫ��Դ֮һ���Ӻ�ˮ����ȡþ���ɰ����²�����У�
�ٰѱ����Ƴ�ʯ���顡
��������ĺ�ˮ�м���ʯ���飬���������ˣ�ϴ�ӳ�����
�۽������������ᷴӦ���ᾧ���ˣ�������
�ܽ��õ��IJ������ں��⡣
������ȡþ������˵������ȷ����( )
A. �˷����ŵ�֮һ��ԭ����Դ�ḻ
B. ���Т٢ڢ۲����Ŀ���ǴӺ�ˮ����ȡMgCl2
C. ������ȡþ�Ĺ������漰�ķ�Ӧ���Ƿ�������ԭ��Ӧ
D. ������ȡþ�Ĺ������漰�ķ�Ӧ�зֽⷴӦ�����Ϸ�Ӧ���ֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���3 mol A��1 mol B�����������ڹ̶��ݻ�Ϊ2 L���ܱ������У��������·�Ӧ��3A��g����B��g��![]() xC��g����2D��g����2 minĩ�÷�Ӧ�ﵽƽ�⣬�������0.8 mol D�� 0.4 mol C�������ж�����ȷ����
xC��g����2D��g����2 minĩ�÷�Ӧ�ﵽƽ�⣬�������0.8 mol D�� 0.4 mol C�������ж�����ȷ����
A. x ��1
B. 2 minʱ��A��Ũ��Ϊ0.9mol��L-1
C. 2 min��A�ķ�Ӧ����Ϊ0.3 mol��L-1��min-1
D. B��ת����Ϊ60%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��г������ڱ���ǰ20��Ԫ���е�ʮ��Ԫ�ص�������ݣ�
Ԫ�ر�� Ԫ������ | �� | �� | �� | �� | �� | �� | �� | �� | �� | �� |
ԭ�Ӱ뾶��10��10m�� | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
���̬ | +1 | ��1 | �� | ��3 | ��4 | ��5 | ��7 | ��1 | ��5 | �� |
��ͼ�̬ | �� | �� | -2 | �� | -4 | -3 | -1 | �� | -3 | -1 |
�Իش��������⣺
��1������10��Ԫ�ص�ԭ���У�������ʧȥ���ӵ���________����Ԫ�ط��ţ�����H2�������ϵķǽ���������________��д�������ƣ���
��2�������γɵļ��⻯��ΪA�����γɵļ��⻯��ΪB,����ߵķе�A______B(����ڡ���С�ڡ�)
��3��д��Ԫ�آ��γɵ�һ�־���ǿ�����Ե��⻯��ĵ���ʽ______________��
��4��д�������ݡ��ޡ�������Ԫ���е�ij����Ԫ���γɵĻ������У�ÿ��ԭ�Ӷ����������Ϊ8�����ȶ��ṹ��һ�����ʵķ���ʽ______________���ݵ����������ĽṹʽΪ__________��
��5��д���ܵ�����������ˮ������ߵ�����������ˮ���ﷴӦ�Ļ�ѧ��Ӧ����ʽ��________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʷ����У�ǰ�߰������ߵ��ǣ� ��
A������������� B������������
C����Һ�� ���� D���û���Ӧ��������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ksp��Mg(OH)2��=1.8��10-11����Mg(OH)2��ˮ�е��ܽ��Ũ��Ϊ
A. 2.6��10-4mol/L B. 1.7��10-4mol/L C. 4.2��10-6mol/L D. 3.2��10-22mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��t��ʱ,�� 2molSO2 �� 1molO2 ͨ�����Ϊ 2L �ĺ��º����ܱ�������,�������·�Ӧ:2SO2(g)+O2(g)![]() 2SO3(g) ,��H=-196.6kJ/mol. 2min ʱ��Ӧ�ﵽ��ѧƽ��,��ʱ��÷�Ӧ��O2 ��ʣ�� 0.8mol,����д���пհ�:
2SO3(g) ,��H=-196.6kJ/mol. 2min ʱ��Ӧ�ﵽ��ѧƽ��,��ʱ��÷�Ӧ��O2 ��ʣ�� 0.8mol,����д���пհ�:
(1)�ӷ�Ӧ��ʼ���ﻯѧƽ��,���� SO3 ��ƽ����Ӧ����Ϊ__________ ��ƽ��ʱ,SO2 ת����Ϊ_____________
(2)����������֤���÷�Ӧ�Ѵﵽ��ѧƽ��״̬���� __________
A.������ѹǿ���ٷ����仯 B.SO2 ������������ٷ����仯
C.����������ԭ���������ٷ����仯 D.��ͬʱ�������� 2nmolSO2 ��ͬʱ���� nmolO2
E.��ͬʱ�������� 2nmolSO2 ��ͬʱ���� nmolO2 F.��������ܶȲ��ٱ仯
(3)���²���������ѧ��Ӧ���ʱ�����__________
A.��������ͨ��O2 B.������������� C.ʹ��������
D.�����¶� E.��������ͨ�뺤����
(4)t2��ʱ,�������ʵ���֮�� n(SO2) :n(O2)=1:1 �Ļ������ͨ��һ�����º�ѹ���ܱ�������,��Ӧ�ﵽƽ��ʱ,���������������� 20%����SO2 ��ת����Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���A������������ܶ���30��ȡ�л���A 6��0g��ȫȼ�պ�����0��2molCO2��0��2molH2O�����л���ȿ�������Ʒ�Ӧ���ֿ����������ƺ�̼���Ʒ�Ӧ��
��1��������л���ķ���ʽ��
��2�����ݸ��л�������ʣ�д����ṹ��ʽ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com