
【题目】t℃时,将 2molSO2 和 1molO2 通入体积为 2L 的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ,△H=-196.6kJ/mol. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
2SO3(g) ,△H=-196.6kJ/mol. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成 SO3 的平均反应速率为__________ ;平衡时,SO2 转化率为_____________
(2)下列叙述能证明该反应已达到化学平衡状态的是 __________
A.容器内压强不再发生变化 B.SO2 的体积分数不再发生变化
C.容器内气体原子总数不再发生变化 D.相同时间内消耗 2nmolSO2 的同时消耗 nmolO2
E.相同时间内消耗 2nmolSO2 的同时生成 nmolO2 F.混合气体密度不再变化
(3)以下操作会引起化学反应速率变快的是__________
A.向容器中通入O2 B.扩大容器的体积 C.使用正催化剂
D.升高温度 E.向容器中通入氦气。
(4)t2℃时,若将物质的量之比 n(SO2) :n(O2)=1:1 的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了 20%。则SO2 的转化率为__________。
【答案】 0.1mol.L-1.min-1 20% ABE ACD 80%
【解析】(1)还剩余0.8 mo1氧气可知:反应消耗0.4mol SO2和0.2mol O2,生成0.4mol SO3,三氧化硫的反应速率为v(SO3)= ![]() =
= =0.1molL-1min-1,SO2转化率=
=0.1molL-1min-1,SO2转化率=![]() ×100%=20%,故答案为:0.1molL-1min-1;20%;
×100%=20%,故答案为:0.1molL-1min-1;20%;
(2)A.容器内压强不再发生变化,该反应两边气体体积不相等,反应过程中压强是变量,压强不变,该反应达到了平衡状态,故A正确;B.SO2的体积分数不再发生变化,表明正逆反应速率相等,达到了平衡状态,故B正确;C.容器内气体原子总数不再发生变化,根据原子守恒,原子总数始终不变,所以原子总数不能作为判断平衡状态的依据,故C错误;D.相同时间内消耗2nmolSO2的同时消耗nmolO2,都是指的是正反应方向,因此不能作为判断平衡状态的依据,故D错误;E.相同时间内消耗2nmolSO2的同时生成nmolO2,相同时间内消耗2n mol SO2等效于消耗n mol O2,同时生成n mol O2,正反应速率等于逆反应速率,故E正确;F.容器内气体密度不再发生变化,容器容积不变,气体的总质量不变,所以气体的密度始终不变,因此密度不能作为判断平衡状态的依据,故F错误;故答案:ABE;
(3)A.向容器中通入少量O2,即增大氧气的浓度,反应速率加快,故A正确;B.扩大容器的体积,容器内气体的浓度减小,反应速率减慢,故B错误;C.使用正催化剂,反应速率加快,故C正确;D.升高温度,反应速率加快,故D正确;E.向容器中通入少量氦气,当恒容时,各组分的浓度不变,则反应速率不变,故E错误;故选ACD;
(4)t℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,设二氧化硫和氧气物质的量各为1mol,反应达到化学平衡时,混合气体体积减少了20%,根据2SO2(g)+O2(g) ![]() 2SO3(g),反应的氧气体积为混合气体减小的体积,即反应的氧气的物质的量为混合气体减小的减小的物质的量,为2mol×20%=0.4mol,则反应的二氧化硫为0.8mol,转化率为
2SO3(g),反应的氧气体积为混合气体减小的体积,即反应的氧气的物质的量为混合气体减小的减小的物质的量,为2mol×20%=0.4mol,则反应的二氧化硫为0.8mol,转化率为![]() ×100%=80%,故答案为:80%。
×100%=80%,故答案为:80%。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】用铝箔包裹0.1mol金属钠,用针在铝箔上扎一些小孔,用镊子夹住,放入水中,待完全反应后,收集到的气体在标准状况下的体积为( )
A.等于1.12L
B.等于0.56L
C.大于1.12L
D.小于1.12L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):
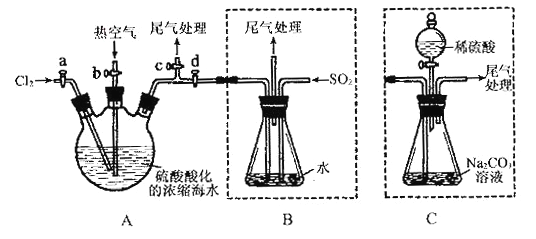
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入至反应结束;②关闭a、c,打开b、d,向A中鼓入足量热空气;③进行步骤②的同时,向B中通入足量SO2 ;④关闭b,打开a,再通过A向B中缓慢通入足量Cl2 ;
⑤将B中所得液体进行蒸馏,收集液溴。
请回答:(1)实验室中采用固液加热制备氯气的化学方程式为______________________;
(2)步骤②中鼓入热空气的作用为_________________________;
(3)步骤③B中发生的主要反应的离子方程式为_____________________。
(4)此实验中尾气可用______________(填选项字母)吸收处理。
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCl溶液
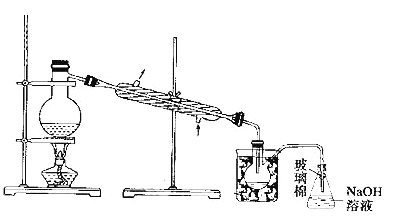
(5)步骤⑤中,用下图所示装置进行蒸馏,收集液溴,将装置图中缺少的必要仪器补画出来。
(6)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBrO3等,请写出滴加稀硫酸时发生反应的离子方程式_________________。
(7)与B装置相比,采用C装置的优点为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式可能是( )
A.  B.
B. ![]()
C. CH3CH2CH2CH2CH3 D. CH3CH2CH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业合成氨的原理是N2(g)+3H2(g)=2NH3(g) △H=-93.0kJ/mol
(1)已知一定条件下:2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H=-+1530.0kJ/mol。则氢气燃烧热的热化学方程式为_________________。
(2)如下图,在恒温恒容装置中进行合成氨反应。

①表示N2浓度变化的曲线是_________。
②前25min内,用H2浓度变化表示的化学反应速率是_____________。
③在25min末刚好平衡,则平衡常数K=___________。
(3)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是_______________。
A.气体体积不再变化,则已平衡
B.气体密度不再变化,尚未平衡
C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动
D.平衡后,压缩容器,生成更多NH3
(4)电厂烟气脱氮的主反应为:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H<0
副反应为:2NH3(g)+8NO(g)=5N2O(g)+3H2O(g) △H>0
平衡混合气中N2与N2O含量与温度的关系如下图所示。

请回答:在400~600K时,平衡混合气中N2含量随温度的变化规律是______,导致这种规律的原因是_________(任答合理的一条原因)。
(5)直接供氨式燃料电池是以NaOH溶液为电解质溶液,电池反应为4NH3+3O2=2N2+6H2O。则负极电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年11月,我国首枚大型运载火箭“长征五号”成功发射。该火箭主发动机中所用的液氧(O2)属于
A. 单质 B. 氧化物 C. 化合物 D. 有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2气体通入BaCl2溶液,无明显现象,然后再通入X气体或加入X溶液,有白色沉淀生成,X不可能是( )
A.Cl2
B.CO2
C.H2O2
D.NH3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据元素周期表及元素周期律,下列推测不正确的是
A. H2SiO3的酸性比H2CO3的强
B. Mg(OH)2的碱性比Be(OH)2的强
C. HCl的热稳定性比H2S的强
D. Na的金属性比Al的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量),其中错误的是

A.图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀量的关系曲线
B.图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
C.图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线
D.图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀量的关系曲线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com