
【题目】五种短周期元素X、Y、Z、M、N,其原子半径与原子序数的关系如图,下列说法错误的是( )

A. 非金属性:X>Z
B. 气态氢化物的稳定性:M<N
C. X和Y形成的化合物只可能含离子键
D. M最高价氧化物对应的水化物是一种弱酸
【答案】C
【解析】
由于表中均是短周期元素,易知是第二周期和第三周期,故可根据原子半径与原子序数的关系可推知元素X、Y、Z、M、N分别为O、Na、Al、Si、Cl。
A.根据同周期非金属性从左往右越强,同主族非金属性从下往上越强,因而根据位置关系可知非金属性:O>S>Al,即X>Z,A项正确;
B.根据同周期气态氢化物的稳定性从左往右越强,同主族气态氢化物的稳定性从下往上越强,因而根据位置关系可知气态氢化物的稳定性:HCl>SiH4,即M<N,B项正确;
C.X和Y形成的化合物为Na2O2,除了离子键还含有非极性键,C项错误;
D. M最高价氧化物对应的水化物为H2SiO3,硅酸的酸性比碳酸还弱,D项正确。
故答案选C。


科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和限度的说法不正确的是( )
A. 实验室用H2O2分解制O2,加MnO2做催化剂后,反应速率明显加快
B. 在金属钠与足量水反应中,增加水的量能加快反应速率
C. 2SO2+O2![]() 2SO3反应中,SO2的转化率不能达到100%
2SO3反应中,SO2的转化率不能达到100%
D. 实验室用锌和盐酸反应制取氢气,用锌粉比锌粒反应要快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,饱和NaCl溶液的密度为ρ g·cm3,物质的量浓度为c mol/L,则下列说法中不正确的是
A. 温度低于20 ℃时,饱和NaC1溶液的浓度小于c mol/L
B. 此溶液中NaCl的质量分数为(58.5×c/ρ×1000)×100%
C. 将1 L该NaCl溶液蒸干可好到58.5c gNaCl固体
D. 20℃时,NaCl的溶解度S=(5850c/(ρ58.5))g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种黄绿色或橙黄色的气体,极易溶于水,可用于水的消毒杀菌、水体中
是一种黄绿色或橙黄色的气体,极易溶于水,可用于水的消毒杀菌、水体中![]() 等重金属的除去及烟气的脱硫脱硝。回答下列问题:
等重金属的除去及烟气的脱硫脱硝。回答下列问题:
(1)将过硫酸纳![]() 溶液加入亚氯酸钠
溶液加入亚氯酸钠![]() 中可制备
中可制备![]() 中
中![]() 元素的化合价是___________,该反应中氧化剂和还原剂的物质的量之比为________。
元素的化合价是___________,该反应中氧化剂和还原剂的物质的量之比为________。
(2)将![]() 通入
通入![]() 溶液,溶液中可检测到
溶液,溶液中可检测到![]() 同时有黑色
同时有黑色![]() 沉淀生成。该反应的离子方程式为:________________________
沉淀生成。该反应的离子方程式为:________________________
(3)为研究![]() 脱硝的适宜条件,在1 L 200 mg·L-1
脱硝的适宜条件,在1 L 200 mg·L-1![]() 溶液中加
溶液中加![]() 溶液调节
溶液调节![]() ,通入
,通入![]() 气体并测定
气体并测定![]() 的去除率,其关系如下图所示:
的去除率,其关系如下图所示:

①实验中使用的![]() 溶液的物质的量浓度为____________;要使
溶液的物质的量浓度为____________;要使![]() 的去除率更高,应控制的条件是__________________________。
的去除率更高,应控制的条件是__________________________。
②当溶液![]() 时,
时,![]() 的去除率增大的原因是
的去除率增大的原因是![]() 与
与![]() 溶液反应生成更强的吸收剂
溶液反应生成更强的吸收剂![]() ,写出碱性条件下
,写出碱性条件下![]() 脱除
脱除![]() 反应的离子方程式:____________
反应的离子方程式:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B原子的质量数。B原子核内质子数和中子数相等。下列叙述不正确的是( )
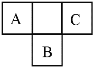
A. C元素是非金属性最强的元素
B. A元素最高价氧化物对应的水化物具有强氧化性
C. B元素的氧化物、氢化物的水溶液都呈酸性
D. 三种元素的原子半径的大小顺序是:B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是( )

A. 原子半径:W>Z>Y>X
B. X的氢化物于水形成的溶液呈碱性
C. 最简单气态氢化物的热稳定性:Z>W
D. Y元素的最高价氧化物的水化物不与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a和b是组成物质种类最多的元素,c是地壳中含量最多的元素,d与b同族,e2+离子的3d轨道中有9个电子。回答下列问题:
(1)c、d两种元素形成的化合物统称硅石,可通过______________方法区分其结晶形和无定形的两种存在形态,c的电子排布图为_______________________。
(2)A和B是生活中两种常见的有机物,A能与CaCO3反应,可用于厨房除水垢;B分子中的碳原子数目与A中相同,可发生银镜反应。A中存在化学键的类型是______;
A.离子键 B.极性键 C.非极性键 D.σ键 E.π键
B分子官能团中碳原子的轨道杂化类型是____。
(3)用“>”或“<”填空:
第一电离能 | 熔点 |
b___d | dc2晶体___d晶体 |
(4)c与e两种元素可形成一种半导体材料,化学式为e2c,在其立方晶胞内部有四个c原子,其余c原子位于面心和顶点,则该晶胞中有____个e原子,e元素位于元素周期表的_______区。
(5)向e2+硫酸盐的水溶液中加入过量的氨水,可得到深蓝色透明溶液,加入乙醇可析出深蓝色晶体,请书写析出晶体的离子方程式___________________。
(6)e单质为面心立方晶体,其原子半径为rcm,其晶胞棱长为a nm,则e单质的密度为__________g·cm-3,其空间利用率的计算式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验某一溶液中是否含有氯离子,可选用的试剂是( )
A.硝酸银溶液
B.稀盐酸酸化的硝酸银溶液
C.稀硝酸酸化的硝酸银溶液
D.稀硫酸酸化的硝酸银溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com