
【题目】根据如图所示转化关系,判断A、B、C、D各是什么物质,写出有关反应的化学方程式:
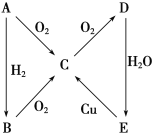
(1)当A为气体单质时:A是_______,B是_______,C是________,D是________,E是________;E→C的离子方程式是______________________________________B→C的化学方程式是__________________________________。
(2)当A为固体单质时:A是______,B是______,C是_______,D是_______,E是______;E→C的化学方程式是______________________________________
【答案】N2 NH3 NO NO2 HNO3 3Cu+8H+(稀) +2NO3- ===3Cu2++2NO↑+4H2O 4NH3+5O2![]() 4NO+6H2O S H2S SO2 SO3 H2SO4 Cu+2H2SO4(浓)
4NO+6H2O S H2S SO2 SO3 H2SO4 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
【解析】
根据硫及其化合物的转化关系分析解答;根据氮及其化合物的转化关系分析解答。
(1) 当A是气体单质时,A能被氧化生成C、C能继续被氧化生成D、D和水反应生成E,E能和Cu反应生成C,则E应该是硝酸,A是N2,C是NO,D是NO2,E是硝酸, A能和氢气反应生成氢化物B,所以B是NH3;
E生成C的化学方程式为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,离子反应方程式为:3Cu+8H+(稀) +2NO3- ===3Cu2++2NO↑+4H2O;
B到C的反应是氨气与氧气反应,方程式为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
故答案为:N2;NH3;NO;NO2;HNO3;3Cu+8H+(稀) +2NO3- ===3Cu2++2NO↑+4H2O;4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2) 当A为固体单质时,A能连续被氧化生成D,D和水反应生成E,E和铜反应生成C,能和Cu反应的酸除了硝酸我们还学过硫酸,所以E是硫酸,则A是S,B是H2S,C是SO2,D是SO3, E生成C的方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
故答案为:S;H2S;SO2;SO3;H2SO4;Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验的说法正确的是
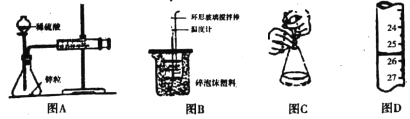
A. 图A中测定锌粒与1mol/L稀硫酸的反应速率,只需测定注射器中收集氢气的体积
B. 图B装置中进行50mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液发生中和反应放出热量的测定,使温度计温度升高的热量就是中和反应生成1mol水的热量
C. 图C酸碱中和滴定中,可以在滴定过程中用少量水冲洗锥形瓶内壁
D. 图D滴定管中液面位置如图所示,则此时的读数为26.50mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水体污染的治理是化学工作者研究的重要课题。
(1)水体常见污染物之一的氨氮主要指游离氨或铵盐,可以通入一定量的氯气,利用产生的HC1O除去。
已知:NH4++HClO=NH2Cl+H++H2O △H=akJ/mol
2NH2Cl+HClO=N2+H2O+3H++3Cl- △H=bkJ/mol
NH4++4HClO=NO3-+6H++4Cl-+H2O △H=ckJ/mol
则2NH4++3HClO=N2+3H2O+5H++3Cl- △H=______kJ/mol
(2)电解法也可除去水中的氨氮,实验室用石墨电极电解一定浓度的(NH4)2SO4与NaCl的酸性混合溶液来模拟。
①电解时,阳极的电极反应式为______________。电解过程中溶液初始Cl-浓度和pH对氨氮去除速率与能耗(处理一定量氨氮消耗的电能)的影响关系如图1和图2所示:
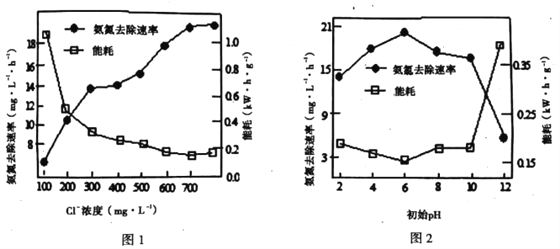
②图l中当Cl-浓度较低时、图2中当初始pH达到12时,氨氮去除速率低而能耗高的原因可能是_______________________。
③图2中,pH为____时处理效果最佳;当pH过低时,处理效果不佳的原因可能是_______。
(3)废水中的重金属离子通常用沉淀法除去。已知Ksp(NiS) =1.1×l0-21.Ksp(CuS)=1.3×10-36,国家规定的排放标准:镍低于1.1×10-5mol/L,铜低于7.8×l0-5mol/L。则需要控制溶液中S2-的浓度不低于______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
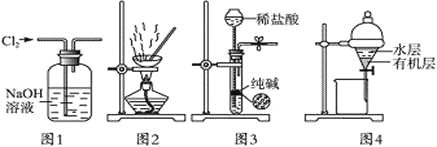
A. 用图1所示装置除去Cl2中含有的少量HCl
B. 用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C. 用图3所示装置制取少量纯净的CO2气体
D. 用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A. 分液、蒸馏、萃取 B. 萃取、蒸发、分液
C. 分液、萃取、蒸馏 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作如下: ①用标准溶液润洗滴定管2-3 次,取标准NaOH 溶液注入碱式滴定管至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“0”或“0”刻度线稍下,并记下读数;④量取20.00mL待测液注入清净的锥形瓶中,并加入3滴酚酞溶液;⑤用标准液滴定至终点,记下滴定管液面读数;⑥重复以上滴定操作2-3 次。
请回答下列问题:
(1)步骤④中,若在取盐酸的滴定管尖嘴部分有气泡且取液结束前气泡消失,则测定结果____(填“偏大”、“偏小”或“无景响”)。
(2)判断到达滴定路点的依据是____________。
(3)以下是实验数据记录表
滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 21.10 |
2 | 20.00 | 0.00 | 19.40 |
3 | 20.00 | 0.00 | 19.32 |
以上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是__________
A.NaOH 标准液保存时间过长,有部分变质
B.锥形瓶用待测液润洗
C.配制NaOH 标准液所用的药品中混有KOH固体
D.滴定结束时,俯视读数
(4)根据上表记录数据,通过计算可得,该盐酸浓度为_____mol/L。
(5)室温下,用0.100mol/LNaOH溶液分别滴定20.00mL0.100mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是_________
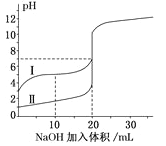
A.V(NaOH)=20mL时,c(Cl-)=c(CH3COO-)
B.I表示的是滴定盐酸的曲线
c.pH=7时,滴定醋酸消耗V(NaOH)小于20mL
D.V(NaOH)=10mL时,醋酸溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某人设计淀粉利用方案如下图所示:
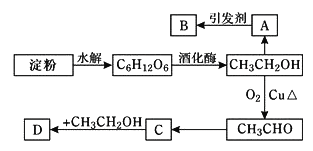
已知:A是乙烯能催熟水果,B是高分子化合物,D是有水果香味的物质。请回答以下问题:
(1)A的电子式为_____________;
(2)写出下列转化的化学方程式:
①C→D:___________________,②CH3CH2OH→CH3CHO:____________________。
II.某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。
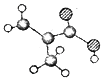
(3)该物质的分子式为______,该物质中所含官能团的名称为_______。
(4)写出该物质生成高分子的化学方程式:________________________。
(5)下列物质中,与该物质互为同分异构体的是________
①CH3CH=CHCOOH ②CH3CH(CH3)COOH ③CH3CH2CH=CHCOOH ④CH2=CHCOOCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列括号内的杂质,所加试剂和操作均正确的是
选项 | 需除杂的物质 | 试剂 | 操作 |
A | Cl2(HCl) | 饱和食盐水 | 洗气 |
B | NaBr溶液(NaI) | Cl2 | 洗气 |
C | Cl2(H2O) | 碱石灰(CaO和NaOH) | 洗气 |
D | 铁粉(铝粉) | 稀硫酸 | 过滤 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
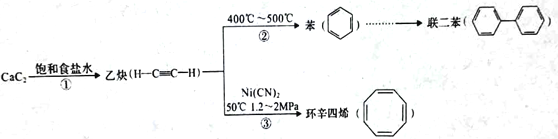
(1)反应①类似盐的水解,写出CaC2的电子式_________。
(2)苯是由哪位科学家首先发现的________,苯分子中有三个氢原子被-Br、-Br、-OH取代得到的芳香族化合物有_____种。将苯分子中的一个碳原子换成一个氮原子,得到一种类似苯环结构的稳定有机物,则此有机物的相对分子质量为________。
(3)写出反应③的化学反应方程式并注明反应类型__________。
(4)联二苯的化学式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com