
【题目】下列表示正确的是( )
A.氯化镁的电子式:![]()
B.氘(2H)原子的结构示意图:
C.乙烯的结构式:CH2=CH2
D.CO2的比例模型:![]()
【答案】B
【解析】
A.相同离子不能合并;
B.氘(2H)原子中有1个质子,核外有1个电子;
C.结构式中需要用短线代替所有的共用电子对,CH2=CH2为结构简式;
D.比例模型表示原子的相对大小及原子连接顺序、空间结构。
A.氯化镁属于离子化合物,镁离子直接用离子符号表示,氯离子需要标出最外层电子及所带电荷,氯化镁的电子式为:![]() ,故A错误;
,故A错误;
B.氘(2H)原子中有1个质子,核外有1个电子,原子结构示意图: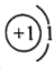 ,故B正确;
,故B正确;
C.乙烯分子中含有2个碳原子和4个氢原子,两个碳原子之间通过共用2对电子形成一个碳碳双键,碳碳键与碳氢键之间夹角120度,为平面型结构,其结构式为:![]() ,故C错误;
,故C错误;
D.二氧化碳的分子式为CO2,由模型可知小球为碳原子,2个大球为氧原子,而氧原子半径小,实际碳原子半径大于氧原子半径,二氧化碳为直线型结构,其正确的比例模型为![]() ,故D错误;
,故D错误;
故选:B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列装置所示的实验中,不能达到实验目的是
|
|
|
|
A.长时间看到Fe(OH)2白色沉淀 | B.证明ρ(煤油)< ρ(钠) < ρ(水) | C.探究氧化性: KMnO4>Cl2>I2 | D.比较NaHCO3、Na2CO3的热稳定性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。根据已知信息回答下列问题:
(1)已知:P和Cl2分两步反应生成1mol PCl5的热化学方程式:
P(s)+3/2Cl2(g)![]() PCl3(g) △H1=-306kJ/mol
PCl3(g) △H1=-306kJ/mol
Cl2(g)+PCl3(g)![]() PCl5(g) △H2=-93kJ/mol
PCl5(g) △H2=-93kJ/mol
①P和Cl2一步反应生成1molPCl5的△H3=______________ kJ/mol。
②工业上制备PCl5通常也分两步进行,通常将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5,原因是____________________________________________。
③PCl5与足量水充分反应,最终生成两种酸,其中一种是P的最高价含氧酸,其化学方程
式是________________________________________________________。
(2)反应PCl3(g)+Cl2(g)![]() PCl5(g)在容积为10L的密闭容器中进行。起始时PCl3和Cl2均为0.2mol,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
PCl5(g)在容积为10L的密闭容器中进行。起始时PCl3和Cl2均为0.2mol,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
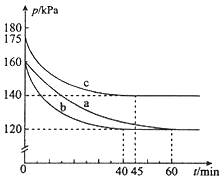
温馨提示:同温同容下的气体,压强之比就等于物质的量之比
①已知实验b平衡时气体的总物质的量为0.30mol,计算实验b反应开始至达到平衡时的反应速率v(PCl5)=_______________,PCl3的平衡转化率为__________________。
②图中3组实验从反应开始至达到平衡时的反应速率v(PCl5)由小到大的次序为____(填实验序号);与实验a相比,c组改变的实验条件是升高温度,判断依据是_________,若α表示PCl3的平衡转化率,实验a和c的平衡转化率:αa______αc(填“<”或“>”);b组改变的实验条件是加入了催化剂,判断依据是_______________________________。
③用p0表示开始时总压强,p表示平衡时总压强,则α(表示PCl3的平衡转化率)的表达式为____(用p0,p表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C又叫抗坏血酸,是一种水溶性维生素,只含有C、H、O三种元素,其球棍模型如图所示。下列关于维生素C的说法正确的是( )
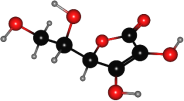
A.维生素C的分子式C6H8O6
B.维生素C含有1个手性碳原子
C.维生素C不能使溴水褪色
D.1mol维生素C与足量的钠反应能产生2molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,实验探究能激发学生学习化学的兴趣。某化学兴趣小组设计如图实验装置(夹持设备已略)制备氯气并探究氯气及其卤族元素的性质。回答下列问题:

(1)仪器a的名称是______________。
(2)A装置中发生的化学反应方程式为_________________________________。若将漂白粉换成KClO3,则反应中每生成21.3g Cl2时转移的电子数目为____NA。
(3)装置B可用于监测实验过程中C处是否堵塞,若C处发生了堵塞,则B中可观察到__________。
(4)装置C的实验目的是验证氯气是否具有漂白性,此时C中Ⅰ、Ⅱ、Ⅲ依次可放入____(填选项a或b或c)。
选项 | Ⅰ | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
b | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
c | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可观察到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴,打开活塞,将D中少量溶液加入E中,振荡E,观察到的现象是_______________________________,该现象_____(填“能”或“不能”)说明溴的非金属性强于碘,原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前50 s的平均速率为v(PCl3)=0.0032mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用分类和氧化还原反应的知识能实现物质的转化。
(1)请从下列试剂中选择合适的完成指定转化(试剂可以重复选择)。
试剂:浓硫酸、I2、NaOH、NaCl、HCl
①HBr→Br2的化学方程式:___;
②V2O5(酸性氧化物)→VO![]() 的离子方程式:___。
的离子方程式:___。
(2)利用含碘酸性废水(其中碘主要以IO![]() 形式存在)为原料生产CuI,其流程如图:
形式存在)为原料生产CuI,其流程如图:

①写出“反应Ⅰ”的离子方程式为___;
②写出“反应Ⅱ”的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沙丁胺醇是一种新型药物,常用于缓解哮喘等肺部疾病,其一种合成路线如图: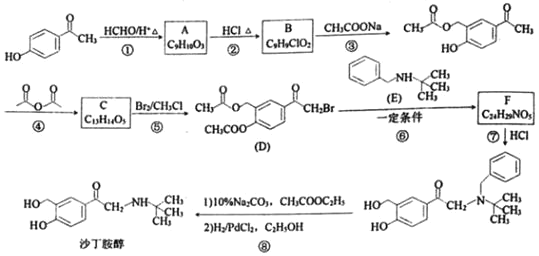
已知:RX+![]() →
→![]() +HX
+HX
请回答:
(1)化合物C的结构简式为___。
(2)反应⑦的化学方程式为___。
(3)下列说法不正确的是___。
A.化合物A能与FeCl3溶液发生显色反应
B.化合物B能发生消去反应
C.1 mol 化合物D最多能与3mol NaOH反应
D.沙丁胺醇的分子式为C13H19NO3
(4)写出同时符合下列条件的化合物E的所有同分异构体的结构简式___。
①IR谱表明分子中含有﹣NH2,且与苯环直接相连;
②1H﹣NMR谱显示分子中有五种不同化学环境的氢原子,且苯环上只有一种氢原子。
(5)请设计以甲苯和异丁烯[CH2=C(CH3)2]为原料合成化合物E的合成路线___(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中充入CO2与H2进行反应:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时CO2的转化率α(CO2)随反应温度T的变化曲线如下图所示(忽略温度对催化剂活性的影响):
CH3OCH3(g)+3H2O(g) ΔH。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时CO2的转化率α(CO2)随反应温度T的变化曲线如下图所示(忽略温度对催化剂活性的影响):
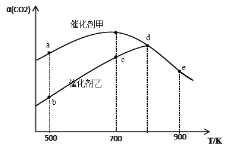
下列叙述正确的是
A. 该可逆反应的ΔH>0
B. 催化剂甲作用下反应的活化能比催化剂乙作用下反应的活化能大
C. 500K下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率高
D. d、e两点反应已经达到平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com