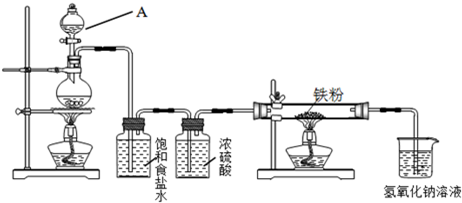
瑞典化学家舍勒在研究软锰矿(主要成分是MnO
2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:

(1)A仪器的名称是
分液漏斗
分液漏斗
,所盛试剂是
浓盐酸
浓盐酸
,B中发生反应的化学方程式是
MnO
2+4HCl(浓)
MnCl
2+2H
2O+Cl
2↑
MnO
2+4HCl(浓)
MnCl
2+2H
2O+Cl
2↑
.
(2)漂白粉将在U形管中产生,其化学方程式是
2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O
2Cl2 +2Ca(OH)2=CaCl2 +Ca(ClO)2 +2H2O
.
(3)此实验结果所得Ca(ClO)
2产率太低.经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO
3)
2,为避免此副反应的发生,可采取的措施是
将U形管置于冷水浴中
将U形管置于冷水浴中
.
②试判断另一个副反应(写出此反应方程式):
2HCl+Ca(OH)2=CaCl2+2H2O
2HCl+Ca(OH)2=CaCl2+2H2O
.为避免此副反应发生,应采取的措施是
在B、C之间增加一个饱和食盐水洗气装置
在B、C之间增加一个饱和食盐水洗气装置
.
(4)漂粉精同盐酸作用产生氯气:Ca(ClO)
2+4HCl=2Cl
2↑+CaCl
2+2H
2O,该反应中每生成1 mol Cl
2,转移电子的物质的量为
1
1
mol,被氧化的HCl的物质的量为
1
1
mol.有效氯是漂粉精中有效Ca(ClO)
2 的含量大小的标志.已知:有效氯=(漂粉精加盐酸所释放出的氯气的质量/漂粉精的质量)×100%,该漂粉精的有效氯为65%,则该漂粉精中Ca(ClO)
2的质量分数为
65.5%
65.5%
(保留一位小数).




 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案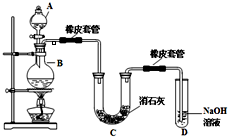 瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: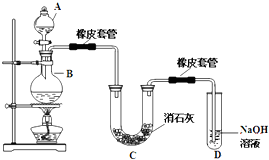 瑞典化学家舍勒在研究软锰矿(主要成分是 MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成分是 MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: