
【题目】某一元弱酸(用HA表示)在水中的电离方程式是:HA![]() H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向______________(填“正”、“逆”)反应方向移动。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向______________(填“正向”、“逆向”、或“不移动”)移动,溶液pH将______________中(填“增大”、“减小”或“不变”),溶液中![]() 比值______________(填“增大”、“减小”或“不变”).
比值______________(填“增大”、“减小”或“不变”).
(3)在25℃下,将a molL-1的氨水与0.01molL-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液呈中性,用含a的代数式表示NH3H2O的电离常数Kb=______________.
【答案】(1)逆;(2)正,增大,不变;(3)![]()
【解析】
试题分析:(1)向溶液中加入适量NaA固体,A-浓度增大,以上平衡将向逆反应方向移动。
(2)若向溶液中加入适量NaCl溶液,相当于稀释,以上平衡将向正向移动,但氢离子浓度降低,溶液pH将增大,溶液中![]() ,温度不变所以比值不变。
,温度不变所以比值不变。
(3)在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液呈中性,c(H+)=c(OH-),平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得n(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3H2O的电离常数![]() 。
。


科目:高中化学 来源: 题型:
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaClO、NaClO3的混合液,经侧定ClO-和ClO3-的浓度之比为l : 3 ,则Cl2与NaoH 溶液反应时被还原的氯原子与被氧化的氯原子的物质的量之比( )
A.21:5 B.11:3 C.3:1 D.4:l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成,可以发生如图转化,下列说法不正确的是( )
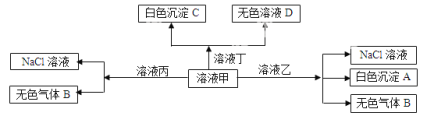
A.在甲中滴加丁可能发生反应:HCO3-+ Ba2++OH—= BaCO3↓+ H2O
B.溶液丙中还可以大量共存的离子有:I-、NO3-、SO42-
C.白色沉淀A可能溶解在溶液D中
D.甲为NaHCO3,乙为 AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,加“碘”食盐中较少使用碘化钾,因其口感苦涩且在贮藏和运输中易变化,目前代之加入是
A. I2 B. KIO C. NaIO D. KIO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与技术、社会和环境密切相关。下列说错误的是( )
A.采用纳米二氧化钛光触媒技术,将汽车尾气中的NO和CO转化为无害气体
B.利用二氧化碳制造全降解塑料,可以缓解温室效应
C.充分开发利用天然纤维,停止使用各种化学合成材料
D.加大秸秆的综合利用,如发酵制沼气、生产乙醇等,提高资源的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把NaHCO3和Na2CO3·10H2O混合物6.56g溶于水制成100ml溶液,测得溶液中c(Na+)=0.5mol/L。
向该溶液中加入盐酸至不再产生气体为止,将溶液蒸干后,所得固体质量为___________。
(2)将24.0g氢氧化钠固体放入水中,要使100个水分子中就含有一个Na+离子,所需水的质量为_________________。
(3)现有HNO3和NaNO3的混合溶液200mL,其中 HNO3和NaNO3的物质的量浓度均为1mol/L.若要使 HNO3和NaNO3 的物质的量浓度分别为2mol/L 和0.2mol/L,则须加入63%的浓硝酸(密度为1.2g/cm3)___________mL,再加入蒸馏水稀释至_______毫升才能实现。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的乙醇电池,它用磺酸类质子溶剂.电池总反应为:C2H5OH+3O2=2CO2+3H2O, 电池示意如图,下列说法正确的是( )

A.A处通氧气,B处通乙醇
B.电池工作时电子由a极沿导线经灯泡再到b极
C.电池正极的电极反应为:O2+2H2O+4e-=4OH-
D.若用这种电池作电源保护金属铁,则a电极连接石墨,b连接铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是1 L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g ·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
⑴下列“鲜花保鲜剂”的成分中,属于非电解质的是 。
A、蔗糖 B、硫酸钾 C、高锰酸钾 D、硝酸银
⑵“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为 mol.L-1。(只要求写表达式,不需要计算)
⑶配制上述1 L“鲜花保鲜剂”所需的仪器有:烧杯、玻璃棒、药匙、 、 、 。(在横线上填写所缺仪器的名称)
⑷在溶液配制过程中,下列操作正确且对配制结果没有影响的是 。
A.将药品放入容量瓶中加蒸馏水溶解
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用铜制备CuSO4溶液有多种方案,某实验小组给出了以下三种方案:

请回答有关问题:
(1)甲方案:为了节约原料,硫酸和硝酸的物质的量之比最佳为,n(H 2SO 4 ):n(HNO 3 )= 。
(2)乙方案:将6.4g铜丝放到90mL 1.5mol·L -1的稀硫酸中,控温在50℃。加入40mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,得CuSO 4·5H 2O 20.0g【已知有关摩尔质量:M(CuSO4·5H 2O) =250g/mol】。
①反应时温度控制在50℃~60℃,不宜过高的原因是 ;
②本实验CuSO4·5H 2O的产率为 。
(3)丙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4 ,然后过滤、浓缩、结晶。
反应中加入少量FeSO4 可加速铜的氧化,FeSO4 的作用是 ;
反应过程中的的离子方程式为: 、 。
(4)对比甲、乙、丙三种实验方案,丙方案的优点有(写两条): 、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com